文章图片
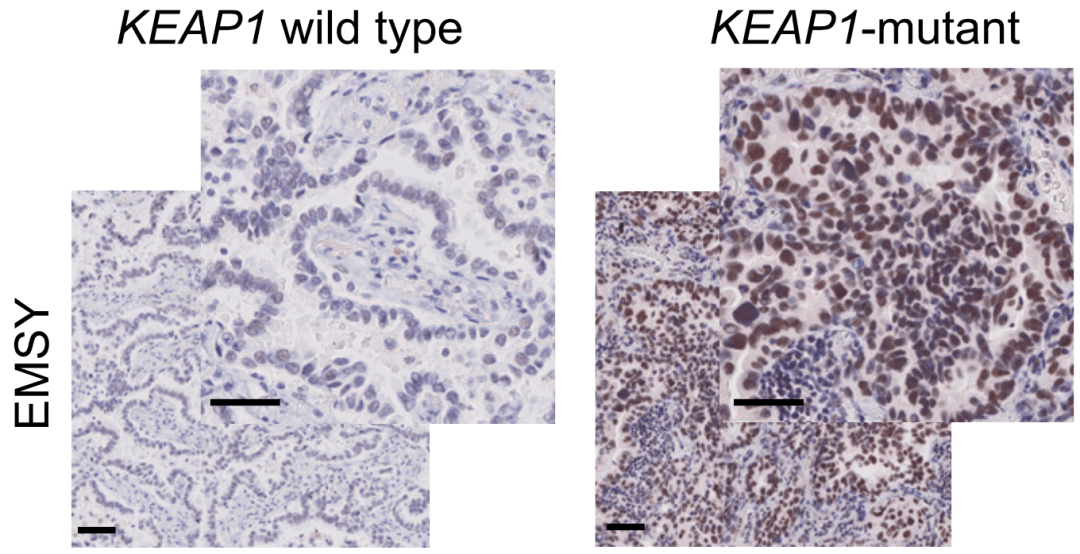
【肿瘤|《细胞》:肿瘤突变负荷飙升3倍,竟然还能逃脱免疫!事出反常必有“妖”】▲ KEAP1突变肿瘤中 , EMSY的表达显著升高
进一步地 , 研究人员发现EMSY的871-874位氨基酸对于其与KEAP1的相互作用所必需的 , 在突变这四个氨基酸后 , EMSY不可被KEAP1靶向降解 。 在给KP肿瘤转染这种不可被降解的EMSY后 , KP肿瘤表现出与KPK肿瘤类似的特征 。 而抑制了KPK肿瘤中的EMSY表达后 , KPK肿瘤对PARP的敏感性也消失了 。 这些结果表明 KEAP1缺陷细胞的BRCAness表型是EMSY蛋白所导致的 。
前面提到 ,KEAP1突变肿瘤的HRR缺陷 , 肿瘤的TMB升高 , 按理说有可能促进天然免疫反应的激活 。 然而与预期相反的是 , 研究人员发现 KPK肿瘤中的干扰素(IFN)信号居然还下调了 。
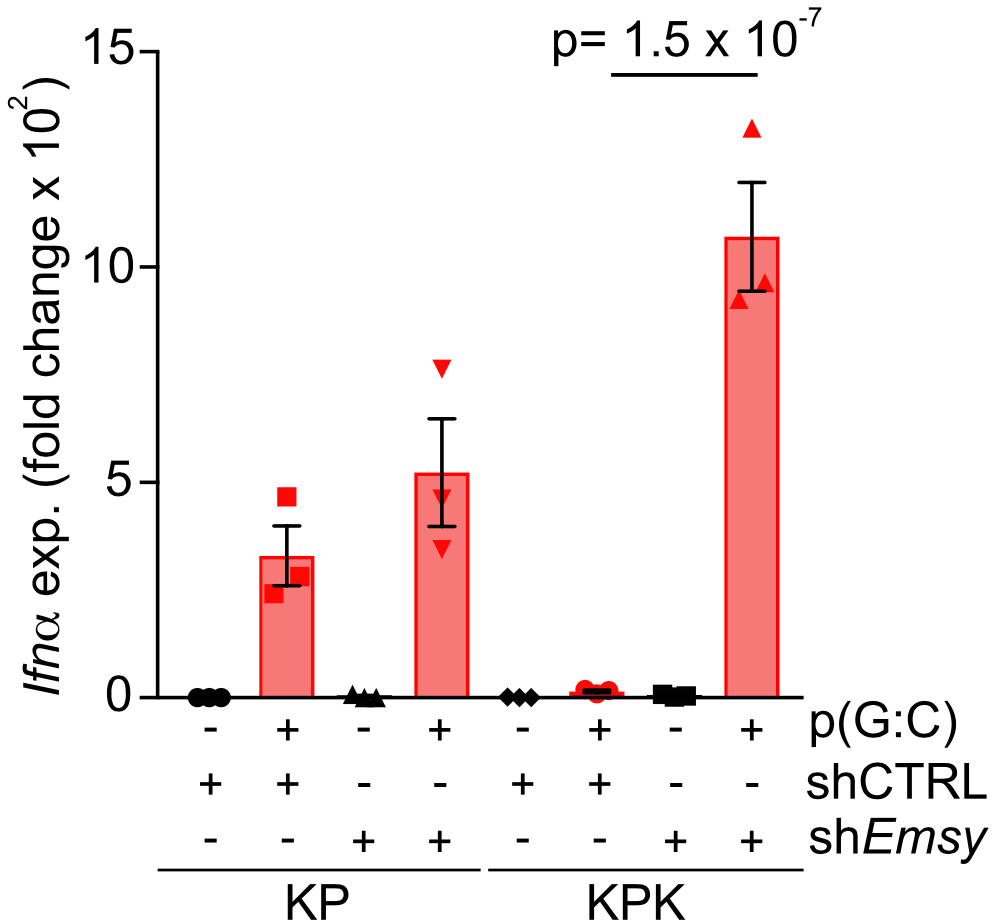
研究人员在抑制了KPK肿瘤中的EMSY表达后发现 , 干扰素刺激基因的表达发生了显著上调 。 进一步地 , 研究人员通过poly(G:C)激活cGAS/STING通路 , 来介导IFN的产生 , 结果发现 EMSY会在poly(G:C)刺激下发生KEAP1依赖的降解 。 在给poly(G:C)处理的KP细胞稳定表达不可降解的EMSY后 , IFN-α的表达和分泌水平均被显著抑制 。
文章图片
▲ 抑制KPK肿瘤的EMSY表达后 , IFN的表达显著升高
这些结果表明 , KEAP1依赖的EMSY降解对I型IFN反应的有效激活至关重要 。 进一步的实验证实 ,KEAP1突变肿瘤中EMSY的高表达 , 可通过抑制I型IFN信号通路 , 进而促进肿瘤免疫逃逸的发生 。
先前的研究发现 , 用STING激动剂激活STING通路 , 不仅能促进癌细胞中I型IFN的产生 , 还能直接激活抗肿瘤免疫细胞 , 促进T细胞向肿瘤微环境迁移和浸润(6) 。 研究人员发现 ,KPK肿瘤对STING激动剂表现出敏感性 , 而KP肿瘤对STING激动剂不敏感 。 单细胞测序和流式分析数据表明 ,STING激动剂可以逆转KPK肿瘤的免疫抑制微环境 。
结合前面的发现 , 研究人员进一步发现 STING激动剂和PARP抑制剂可联合抑制KPK肿瘤的生长 , 但KP肿瘤生长不不受影响 。
因此 , 这些结果表明:联合使用PARP抑制剂 (诱导癌细胞死亡)和STING激动剂 (激活免疫细胞) , 可能在KEAP1失活突变的肺癌治疗中有着良好的应用前景 。
文章图片
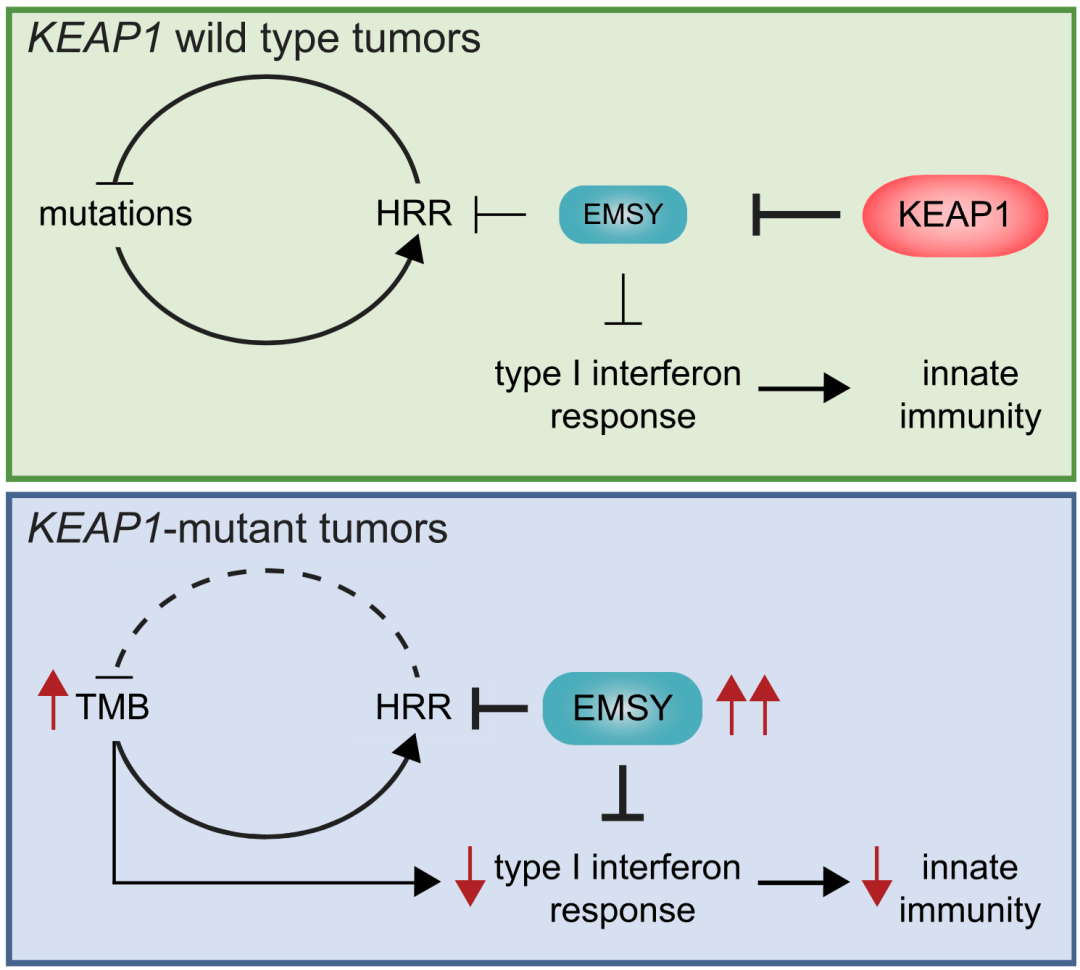
▲ 机制总结图
总的来说 , 这项研究发现KEAP1的缺失可导致EMSY不能被正常降解 , 进而导致肿瘤细胞的HRR缺陷并对PARP抑制剂敏感 。 此外 , EMSY还可以抑制STING通路 , 进而导致肿瘤免疫逃逸的发生 。
因此 ,单独或联合靶向PARP和STING通路可能成为KEAP1突变的肺癌患者的一种治疗策略 。
参考文献
1.N. Cancer Genome Atlas Research, Comprehensive molecular profiling of lung adenocarcinoma. Nature 511, 543-550 (2014).
2.K. Itoh, J. Mimura, M. Yamamoto, Discovery of the negative regulator of Nrf2, Keap1: a historical overview. Antioxid Redox Signal 13, 1665-1678 (2010).
3.X. X. Chen, C. X. Su, S. X. Ren, C. C. Zhou, T. Jiang, Pan-cancer analysis of KEAP1 mutations as biomarkers for immunotherapy outcomes. Ann Transl Med 8, (2020).
4.A. K. Byrum, A. Vindigni, N. Mosammaparast, Defining and Modulating 'BRCAness'. Trends Cell Biol 29, 740-751 (2019).
5.J. Przybycinski, M. Nalewajska, M. Marchelek-Mysliwiec, V. Dziedziejko, A. Pawlik, Poly-ADP-ribose polymerases (PARPs) as a therapeutic target in the treatment of selected cancers. Expert Opin Ther Tar 23, 773-785 (2019).
- al|《柳叶刀》子刊:喝酒易得肝癌?看你有没有这个突变!首个酒精相关肝癌患者的GWAS,发现了一对重要癌相关基因丨临床大发现
- vlVMH|《科学》子刊:徐勇/徐平稳/何彦林合作发现雌激素受体神经元调节体温和运动的神经环路机制
- 颈动脉斑块|血管里的“斑块”可缩小甚至消失!《美国心脏病学会杂志》总结新策略
- 耐受|癌症患者不能吃发物,否则肿瘤会复发?“发物”到底是什么?
- 放疗|肿瘤医生张煜:我不是“叛徒”
- 癌症|广州复大肿瘤医院案例975:胆管细胞性肝癌应该要怎么治疗
- 昭通市|《健康教育三分钟》昭通市中医医院杨迎飞医生告诉您如何预防治疗脑卒中
- 检查|阿姨颈部长肿块以为是肿瘤 谁知竟是10个月前误吞的鱼刺
- 卵泡|广州南医大干细胞
- 相关|南医大干细胞治疗骨关节炎效果显著
