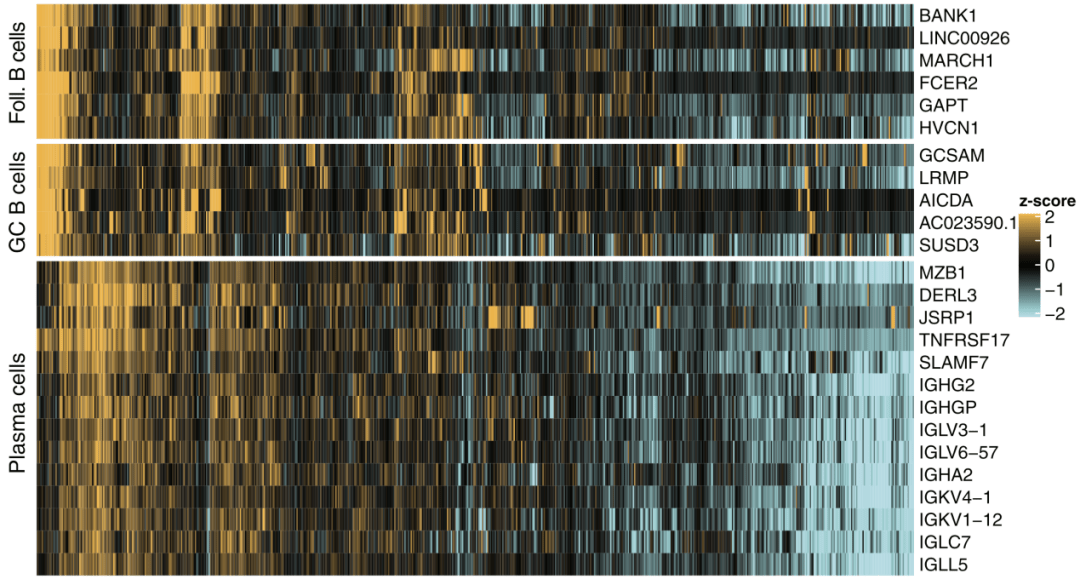
文章图片
三种B细胞特异的基因在bulk-seq中有不错的共表达特性
接着他们通过多重免疫荧光(multiplex IF)实验发现浆细胞的特征基因与肿瘤纯净度无关 , 因此选取浆细胞作为参考是不受肿瘤纯度影响的 。 于是研究人员用免疫荧光技术估计了23个NSCLC肿瘤样本中的浆细胞数量 , 同时利用浆细胞特异的基因表达量也估计了浆细胞的数量 , 发现这两个结果高度相关 , 证明在单细胞数据中找到的浆细胞特异的基因在bulk-seq中能很好的代表浆细胞 , 同时也再一次表明这些基因是浆细胞高度特异基因 。
然后研究人员仿照最开始的分组方式 , 将所有患者先按治疗方案分类 , 再在每一组内根据上述三组特征基因的表达量分为两组—— 表达量最高的1/3患者定义为高表达 , 较低的2/3定义为高表达 。 接着他们比较每个治疗组内 , 特征基因高表达和低表达患者的OS差异 , 发现只有 免疫治疗组中高表达患者的OS比低表达患者更好(HR=0.63, 95% CI: 0.48-0.83) , 化疗组则没有类似的相关性 。
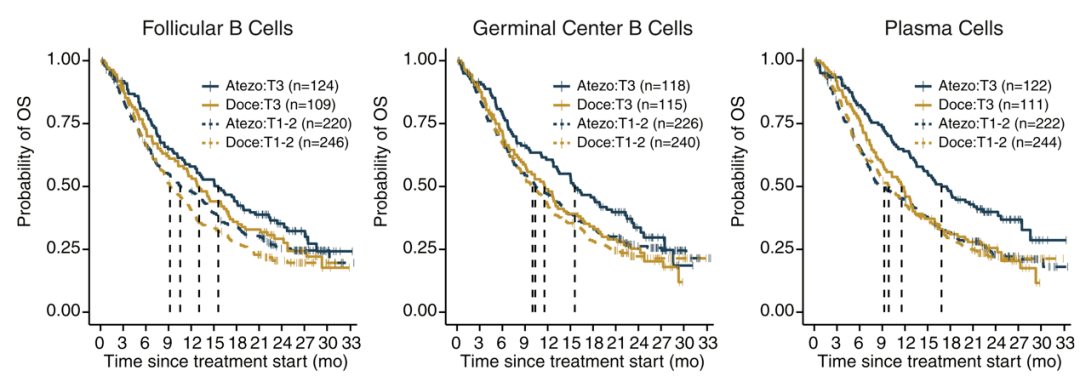
文章图片
只有浆细胞特征基因与NSCLC患者的免疫治疗预后相关
在进一步的验证中 , 研究者将一些已知的免疫治疗预后相关生物标志物加入模型 , 发现浆细胞特征基因的高表达 , 仍然与患者更好的OS有关(HR=0.67, 95% CI: 0.50-0.89) 。
将预后指标换成客观缓解率 , 并按鳞状癌和非鳞状癌区分患者时 , 肿瘤内浆细胞数量更多的患者也都有更长的中位OS 。 而且 , 浆细胞特征基因高表达的患者中 ,约有35%在治疗后实现临床获益(定义为完全缓解/部分缓解+疾病稳定≥6个月的患者) , 而浆细胞较少的患者中这一比例仅为25% 。
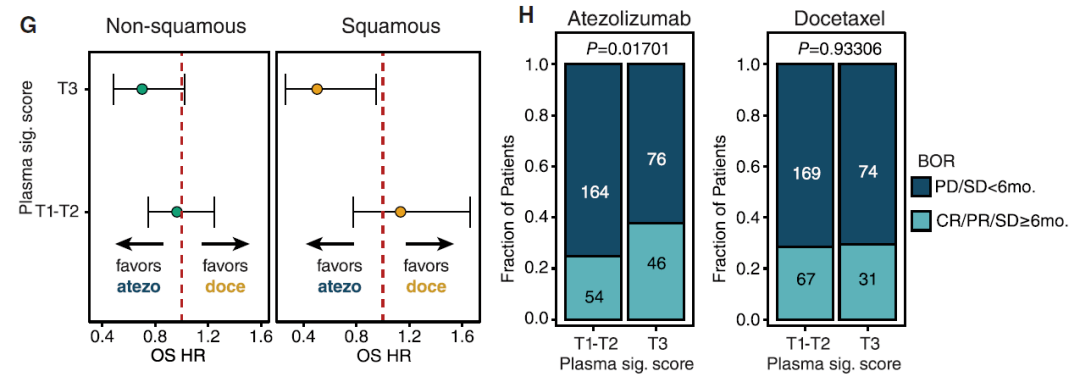
文章图片
无论鳞状癌还是非鳞状癌 , 浆细胞特征基因表达量更多的患者预后更好(G);浆细胞特征基因表达量更高的患者在免疫治疗组中的缓解率更高
以往有研究报道肿瘤内的三级淋巴结构(TLS)中有B细胞的存在 , 因此研究人员探究了TLS与预后的关系[8] , 首先以伊红染色法计算免疫治疗组和化疗组中出现TLS或者淋巴细胞聚集处(LA)的NSCLC肿瘤样本数量 , 发现两组间含有TLS或者LA的肿瘤样本数量差异并不显著 。
而如果比较每组中有TLS/LA患者与没有TLS/LA患者的生存率 , 那么 有TLS/LA且经过免疫治疗的患者的OS更好(HR=0.60, 95% CI: 0.38-0.94) 。根据肿瘤样本是否含有TLS/LA分类时 , 在有TLS/LA的肿瘤样本中 , 三种B细胞亚型的数量均出现了增加 , 表明三种B细胞亚型均富集于TLS/LA 。
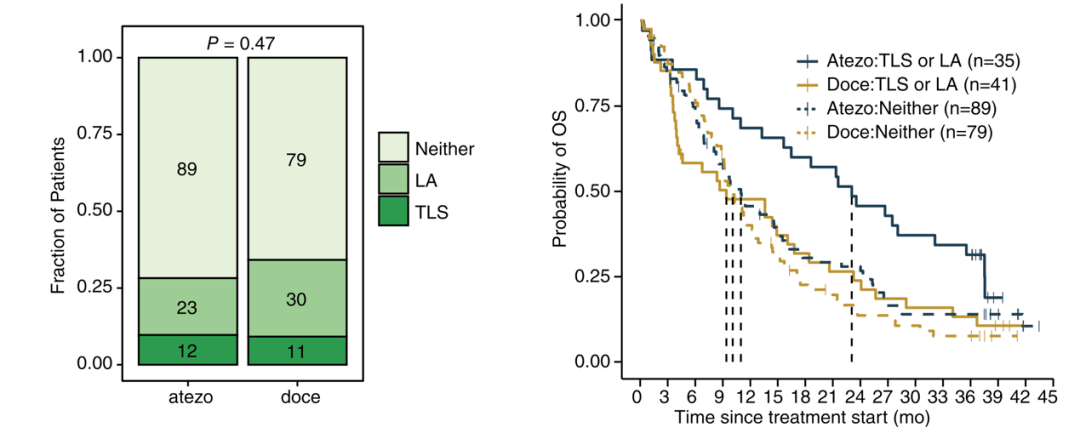
文章图片
两种治疗方案中含有TLS/LA的肿瘤样本数量没有显著差异(左);TLS/LA与经过免疫治疗的患者的预后相关(右)
尽管浆细胞产生抗肿瘤免疫效应的机制并不明确 , 但根据以往发表的研究结果 , 浆细胞可以产生肿瘤抗原特异性的抗体 , 起到杀伤肿瘤细胞和补体激活作用[8] , 同时B细胞也可以激活抗原呈递细胞或者表达特定BCR的B细胞本身就有抗原呈递功能 , 它们可以在耗竭CD8+T细胞被PD-L1抑制剂激活后进一步增强CD8+T细胞的肿瘤杀伤能力[10,11] 。
总的来讲 , 这项研究整合了两个大规模NSCLC临床试验队列的样本bulk-seq转录组数据 , 同时结合额外的单细胞数据 , 证明了肿瘤内浆细胞数量的增加与接受阿替利珠单抗治疗的NSCLC患者出现更好的预后有关 , 并且这种关联性与CD8+T细胞无关 , 研究数据将为NSCLC患者临床治疗中的用药提供参考 。
- 细胞|JITC:颠覆认知!科学家首次发现PD-1抑制剂竟保护特定肠癌细胞,促进结直肠癌生存,免遭放化疗杀伤丨科学大发现
- 中药|《药典》点名:3种中药被禁用,不仅伤肝还致癌,别以为是好药
- 《春季锻炼指南》为您推荐那些春天适宜的运动
- 本文转自:CCTV热线12最近几年|遏制“食金之风”:金箔毫无营养价值,价格虚高潜藏隐患丨《热线12》
- 治疗|由肾病发展到肾衰竭,或会有四种特征,早了解早预防
- 本文转自:全民健康生活方式行动“迟日江山丽|《春季锻炼指南》为您推荐那些春天适宜的运动~
- 强度|《春季锻炼指南》为您推荐那些春天适宜的运动
- 灵芝的5大养生功效
- 起床气|长寿的人有共性?汇总6个特征,照着做,你也可以长寿
- 黑眼圈|肾不好的人,都写在脸上!脸上几个特征明显,劝你排查肾病
