文章图片
白癜风是一种慢性自身免疫性疾病 , 其特征是皮肤色素脱失 , 这是由于黑色素细胞的产生色素细胞的损失所致 。 JAK信号通路的过度激活被认为是炎症的驱动因素 , 参与了白癜风的发病机制和进展 。 Opzelura是FDA批准的首个用于白癜风患者色素沉着的治疗方法 , 也是唯一在美国批准的Janus激酶(JAK)抑制剂的局部制剂 。
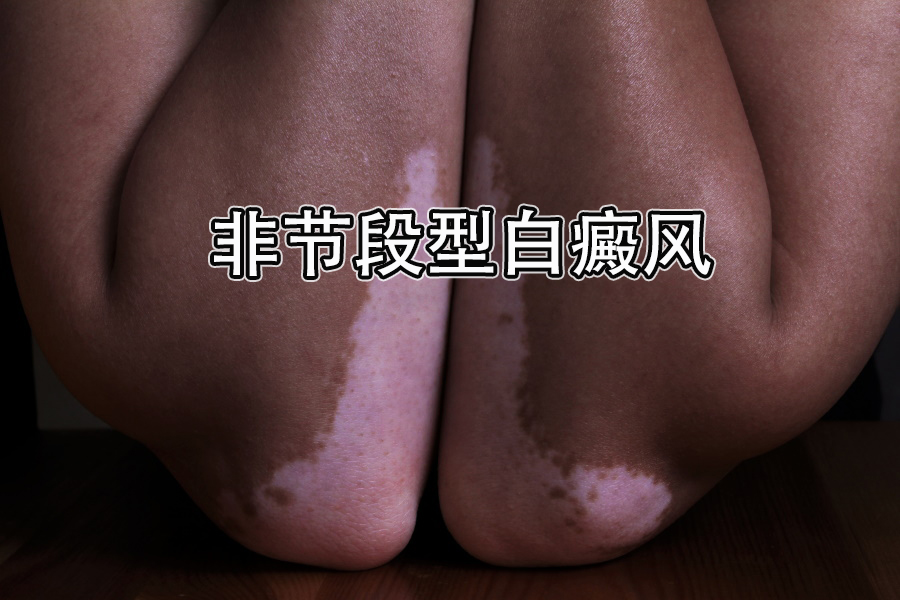
Incyte于7月18日宣布 , 美国食品药品监督管理局(简称FDA)已批准Opzelura(ruxolitinib , 鲁索替尼)乳膏1.5%用于12岁及以上成人和儿童患者的非节段型白癜风的局部治疗 。
对于非节段型白癜风患者 , Opzelura被批准每天连续两次局部使用 , 最大可达10%的体表面积 , 满意的反应可能需要治疗24周以上 。 如果患者在24周后仍未发现有意义的再色素沉着 , 则应考虑重新评估 。
批准是基于第3阶段TRUE-V1(NCT04052425)和TRUE-V2(NCT04057573)研究的数据 , 这两项研究评估了Opzelura乳膏在674名12岁及以上被诊断为非节段型白癜风并有脱色素区域的患者中的有效性和安全性 。
患者被随机分配为2:1 , 每天接受两次Opzelura或赋形剂乳膏治疗 , 持续24周 , 然后对所有患者进行另外28周的Opzelura每日两次治疗 。
主要终点是达到F-VASI75的患者的比例 , 定义为在第24周时面部白癜风面积评分指数(F-VASI)评分比起始至少改善75% 。 一个关键的次要终点是达到F-VASI90的患者比例 。
在True-V1和True-V2中 , 结果显示 , 接受Opzelura治疗的患者在24周时分别有29.9%和29.9%的患者达到F-VASI75 , 而接受赋形剂治疗的患者分别有7.5%和12.9%达到F-VASI75 。
此外 , 在接受TRUE-V1和TRUE-V2治疗的患者中 , 分别有15.5%和15.4%的患者在24周时达到F-VASI90 , 而接受赋形剂治疗的患者的这一比例分别为2.2%和1.9% 。
在第52周 , 接受Opzelura治疗的患者中 , 大约50%达到了F-VASI75 , 大约30%达到了F-VASI90 。
Opzelura报告的最常见的不良反应是涂抹部位痤疮、涂抹部位瘙痒、鼻咽炎、头痛、尿路感染、涂抹部位红斑和发热 。
来自3期TRuE-V研究的第52周数据在美国皮肤病学会(AAD)2022年年会的最新摘要会议上进行了口头陈述 。
2021年9月 , FDA批准Opzelura用于12岁及以上非免疫功能受损患者的轻中度特应性皮炎(AD)的局部短期和非连续性慢性治疗 , 这些患者的疾病无法通过局部处方疗法得到充分控制 , 或者当这些疗法不适用时 。
参考来源:’ Incyte Announces U.S. FDA Approval of Opzelura? (ruxolitinib) Cream for the Treatment of Vitiligo’新闻稿 。 Incyte制药 , 2022年7月18日发布 。
【白癜风|非节段型白癜风皮损复色!FDA批准Opzelura(ruxolitinib)乳膏1.5%】注:以上资讯来源于网络 , 由香港济民药业整理编辑(如有错漏 , 请帮忙指正) , 只为提供全球最新上市药品的资讯 , 帮助中国患者了解国际新药动态 , 仅供医护人员内部讨论 , 不作任何用药依据 , 具体用药指引 , 请咨询主治医师 。
- 这四种高智商血型排名,看看你家孩子排第几?
- 痰液|主任:一招教你学会“如何看痰液颜色区分咳嗽类型!”……【精选】
- 南县明山头镇:新型农机助力夏粮丰收
- 解决中小农户植保难苏州这个共享模式入围全国典型案例
- 白癜风患者可以吃这类食物吗?
- 解决中小农户植保难 苏州这个共享模式入围全国典型案例
- 乙肝新型反义寡核酸和三种优化后ASOs正在临床前
- O型血更长寿的结论,被打破,快来看看
- 身心同治,白癜风患者要打好夏季皮肤“保卫战”
- 运动|夏季白癜风养肤“好伴侣”,这一款肯定适合你
