辉瑞新冠特效药获批后 , 国产药如何闯过审批大门?
如果已有同类型药获批上市 , 在研药物的对照试验 , 则需以上市药物作为药效对照的标准 , 而不是安慰剂试验

文章图片
图/Unsplash
文 | 《财经》采访人员 信娜
编辑 | 孙爱民
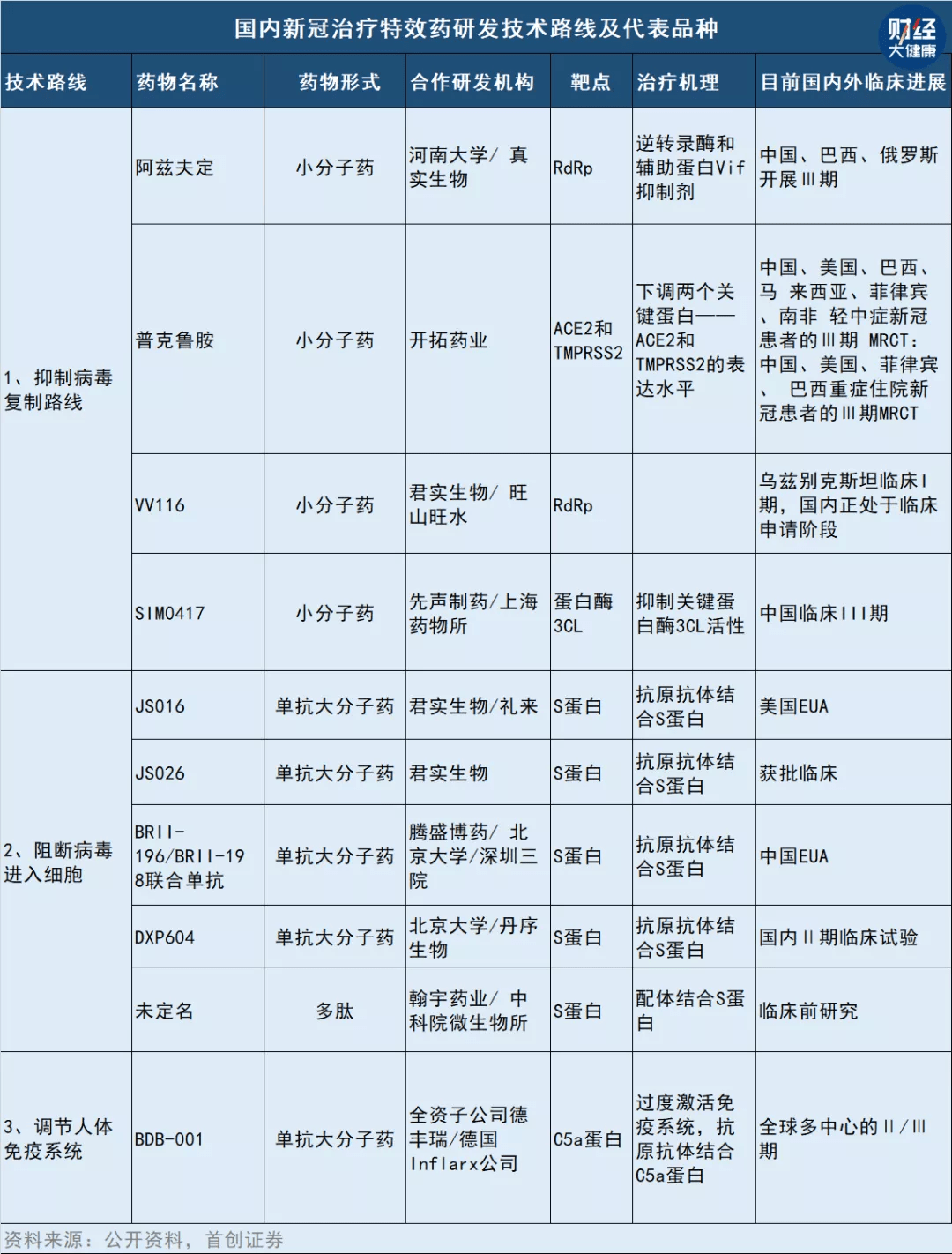
谁想在新冠特效药市场中分得一杯羹 , 都得先过审评这一关 。
2022年2月17日 , 国家药品监督管理局药品审评中心(CDE)发布《新型冠状病毒肺炎抗病毒新药临床试验技术指导原则(试行)》 。
六天前的2月11日 , 国家药监局通过应急审评审批 , 附条件批准辉瑞公司新冠病毒治疗药物奈玛特韦片/利托那韦片组合包装进口注册 。
在批准首个进口特效药后 , 众多国产药企如何继续开展临床试验以满足上市要求?指导原则划出了“跑道” , 从研究到临床试验的各个环节给出指导原则 。
其中 , 广受业内关注的是 , 指导原则对于临床试验设计中标准治疗的表述:在无法获得阳性对照药物的情况下 , 建议采用随机、双盲、安慰剂平行对照、以公认的背景治疗为基础的优效性比较加载设计;如出现确证有效的药物上市可作为标准治疗 , 且拟开发试验药物与标准治疗作用机制相似 , 可以考虑阳性对照的优效或非劣效设计 。
通俗讲 , 如果已有同类型药获批上市 , 在研药物的对照试验 , 需以获批上市的药物作为药效对照的标准 , 而不是安慰剂试验 。 这也意味着 , 如果“后来者”的药效不如已获批上市的药 , 其大概率不会获批上市 。
一位药监系统知情人士分析 , 这对同一路线中研发进程较慢的药企敲响了警钟:除非对自家药物的药效非常有信心 , 否则要么加快研发与临床速度 , 要么尽早放弃、选择差异化路线 。
文章图片
谁能赢得新冠特效药市场 , 竞争才刚刚开始 。
指导原则对哪些企业有影响?
候选药物能解决什么临床问题 , 这是此次CDE发布的指导原则的核心思想 。
该指导原则对临床试验方案设计及需重点关注问题均有所讨论 。 尤为值得注意的是 , 其中对于预期标准治疗的描述:“如出现确证有效的药物上市可作为标准治疗 , 且拟开发试验药物与标准治疗作用机制相似(如标准治疗与试验药物均为直接抗病毒药物) , 可以考虑阳性对照的优效或非劣效设计” 。
这与此前药监部门多次提到的“关门效应”如出一辙 , 即如果已经有同类型药获批上市 , 其他在研药临床试验需与该上市药进行头对头试验 。
一名药监系统知情人士认为 , 此举是为了“避免大家的临床试验设计都去和安慰剂比效果 。 要不然 , 批准的药物疗效数据一直上不去” 。
这意味着 , 如果已经有获批的新冠特效药 , 其他同类药就需要以获批药作为标准治疗进行对照临床试验 。 但已获批药物是进口药还是国产药 , 具体的政策又有所不同 。
如果某个适应症只有进口药获批上市 , 药监部门通常不会要求其他国产药品的临床试验去和进口药头对头试验 。 “这个门槛对现在的中国药企来说太高了 。 ”上述药监系统人士表示 。
但如果在这个领域的治疗里 , 已经有国产药品了 , 并且是广泛应用的 , 就要考虑提高后来者的临床价值 。 这种情况犹如赛跑:已经有人跑到了终点 , 依旧允许刚到起跑线的人起跑的话 , 不太合理 , 尤其是赛道上已有很多选手的情况下 。
- 治疗|26岁小伙屁股剧痛3天,不是痔疮!
- 蛋白|河南启动新冠肺炎疫苗序贯加强免疫
- 医学|治愈,回家!禹州首批10名新冠肺炎患者结束医学隔离
- 李拓|日本单日新增新冠病毒感染人数超过7万人
- 感染者|2月20日0时至15时 苏州新增新冠肺炎确诊病例7例 新增无症状感染者1例
- 防控|今日0时至15时,苏州新增新冠肺炎确诊病例7例
- 疫情|苏州新增新冠肺炎确诊病例7例,均在管控范围内发现
- 隔离|2月20日0时至15时,苏州新增新冠肺炎确诊病例7例,新增无症状感染者1例
- 疫情|今日0时至15时,苏州新增新冠肺炎确诊病例7例
- 新闻|苏州新增新冠肺炎确诊病例7例
