尽管肺癌治疗手段已有显著进步 , 患者长期存活率仍然很低 。
靶向治疗和免疫治疗的快速发展带来了新的曙光 , 但目前仍受制于非常有限的生物标志物和治疗组合方式 。鉴定肺癌特征性基因和克服免疫逃逸成为重要的临床需求 。
近日 , 来自 瑞典Karolinska Institutet的Janne Lehti?团队在《自然·癌症》期刊发表了重要研究成果[1] 。
他们对141份包含所有主流组织学类型的非小细胞肺癌(NSCLC)样本进行了深度 质谱分析 , 鉴别出六种不同蛋白组类型的肺癌 , 它们各自具有特异性免疫细胞组成和免疫检查点表达 。 同时 , 他们还发现 肿瘤新生抗原负荷与基因组超甲基化密切相关 , 并揭示了与免疫逃逸相关联的基因突变和信号通路 。

文章图片
【团队|《自然·癌症》:六个蛋白组亚型,道出肺癌免疫逃逸之谜】▲ 论文首页截图
肺癌是全世界最常见的癌症类型之一 , 预计每年新增病例210万人 。 遗憾的是 , 绝大部分病例得到诊断时已发生转移 , 无法进行手术切除 , 导致NSCLC五年存活率仅有24% , 而IV期病人五年存活率仅有6% 。(https://seer. cancer.gov)
近年来 , 对临床患者的DNA和RNA组学分析 , 展示出了从系统层面理解肺癌的重要性 。 随着现代质谱的发展 , 科学家们终于可以直接测定药物真正靶向的分子 , 即蛋白组 。 蛋白组分析的一个重要特点是 不但能分析样本组织中的癌细胞 , 还包括其中的间质和浸润免疫细胞 。 从而可以提供更加完整的分子表型全景图 , 帮助人们从整体的角度理解肿瘤的特征 。
Lehti?团队选用的141份肿瘤组织样本包含:腺癌(AC) , 鳞状细胞癌(SqCC) , 大细胞神经内分泌癌(LCNEC)和大细胞癌(LCC) 。 另有2份小细胞肺癌(SCLC)样本作为参照 。 由于 晚期(III–IV期)NSCLC很少再涉及手术切除肿瘤 , 这些样本主要属于早期癌组织(I–II期 , 占87%) 。
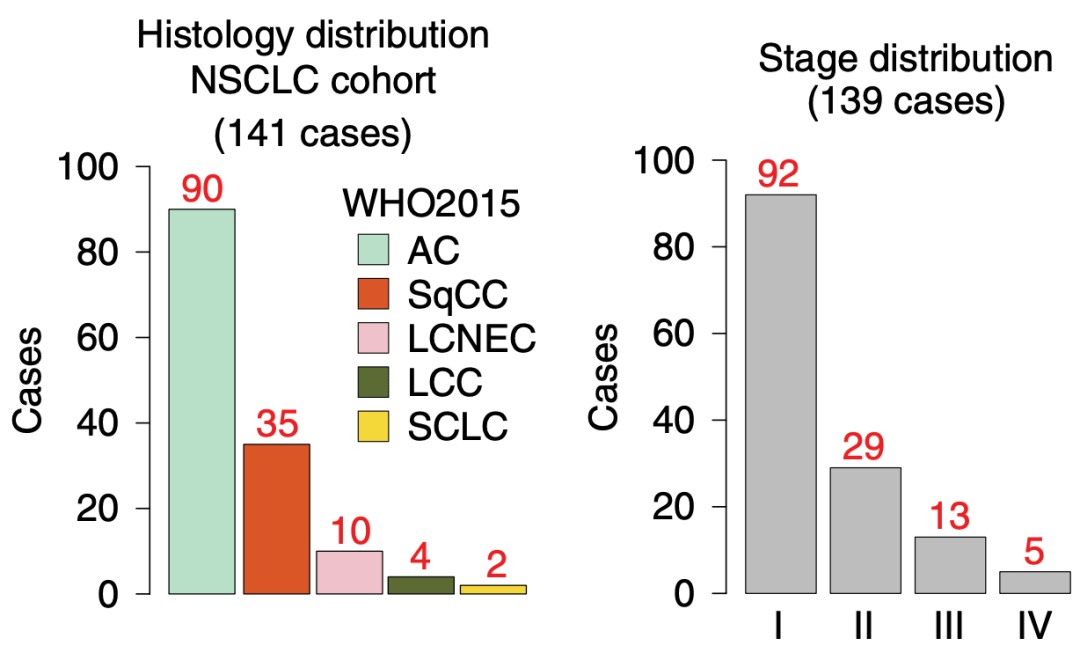
文章图片
▲ 本研究选用的肺癌类型及分期
为了进行全面的分子表征分析 , Lehti?团队采用了等压标记和高分辨率等电聚焦液相色谱质谱(LC–MS) 。 除了质谱数据以外 , 研究者们还进行了370个癌症相关基因的测序分析 , 并在大部分样本中都进行了基因组甲基化和mRNA含量的测定 。
通过一致性聚类分析 , Lehti?团队将NSCLC蛋白质组分成了六个亚型 。亚型1-4中主要包含腺癌(AC , 占比77–100%) 。亚型5主要为大细胞神经内分泌癌(LCNEC , 占比64%) 。亚型6中则集中为鳞状细胞癌(SqCC , 占比96%) 。
两份小细胞肺癌样本均聚类于LCNEC组 , 符合两者均起源于神经内分泌细胞支系的预期 。 另外 ,非吸烟者样本集中在亚型1 , 性别、肿瘤分期、患者年龄没有特殊分布趋势 。
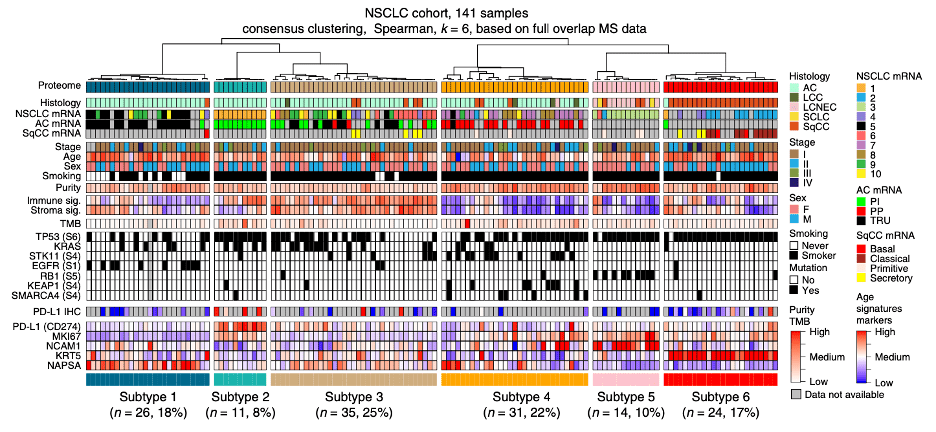
文章图片
▲ NSCLC蛋白质组可分为六类 , 分别记为亚型1-6 , 颜色标记在全文中保持一致
那么均以AC为主的亚型1-4之间有什么区别呢?TCGA网站根据mRNA表达特征将AC进一步分为三类:终端呼吸区(TRU)、近端炎症(PI)和近端增殖(PP)[2] 。 基于这种分类 ,亚型1样本主要为TRU , 亚型2样本主要为PI , 亚型4样本则主要是PP 。 亚型3没有集中任何以上三种mRNA表达特征 。
Lehti?团队同时进行的基因测序表明:亚型1集中存在EGFR突变 , 亚型4集中存在STK11、KEAP1和SMARCA4突变 , 亚型5含有RB1突变 , 亚型6则含有TP53突变 。
- 卫生室|《乡村医生诊疗口袋书(先行本)》面世
- 解读|《浙江省医院门诊管理办法》政策解读
- 廉东波|《健谈》观点丨浅表性胃炎三五年复查一次 萎缩性胃炎一年一查
- 家长|杭州《青少年皮肤健康状况调研》发布,近半青少年受皮肤疾病困扰
- 公报,监测,国民,体质|一图读懂《第五次国民体质监测公报》
- 作者:鲍秀兰专家团队本文转载自“儿科医生鲍秀兰”(xiehebaoxiulan)来源:金...|孩子老喊腿疼,是长高的预兆吗?如果有这些症状别大意
- 感冒|《气血运行影响心脏功能——心悸篇》
- 幽门螺杆菌感染|《健谈》观点丨突然消瘦、胃痛、黑便,应及时做胃镜检查
- 数据|《胃肠病学》:减肥防早发肠癌,要从20岁开始!科学家发现,20、30岁和约45岁时肥胖,与结直肠癌发病风险上升88-156%有关
- 医学|科普连载:《氢气医学人群试验》(漫画版)孙学军教授 序言
