免疫检查点抑制剂(ICB)是肿瘤治疗领域的巨大进步 , 为晚期肿瘤患者提供了更多治疗选择 。 从2010年起 , 多项研究证实PD-1抑制剂在进展期黑色素瘤患者存在持久的临床疗效 。 历经十余年发展 , PD-1抑制剂现在常规用于转移性黑色素瘤 , 且应用逐渐扩展至越来越多的癌症种类 。
PD-1抑制剂单药治疗反应率最高的是霍奇金淋巴瘤 , 约为87% , 但在某些肿瘤类型如非小细胞肺癌、胃食管癌、膀胱癌和尿路上皮癌中 , 反应率仍然较低 , 仅为15-25%[1-3] 。 因此 深入理解作用机制、寻找可以预测对ICB反应的生物标志物至关重要 。
近日 , 由德国图宾根大学医学中心的Kilian Wistuba-Hamprecht领衔的研究团队在 Journal for Immunotherapy of Cancer 发表研究成果 , 发现 外周血中肿瘤抗原反应性T细胞的早期消失提示PD-1抑制剂治疗预后较好[4] 。

文章图片
文章封面
已有研究证明 , 血清乳酸脱氢酶(LDH)基线水平可以预测ICB治疗转移性黑色素瘤的临床获益[5] 。 同时 , 肿瘤细胞上PD-L1表达、肿瘤高突变负荷或黑色素瘤细胞上MHC II类分子表达也有希望作为预测个体对ICB治疗反应的生物标志物[6] 。 然而 ,在临床实践中 , 某些低/阴性表达PD-L1的肿瘤患者也可以在接受PD-1抑制剂治疗后受益 , 因此在制定ICB治疗方案时 , 除PD-L1表达水平外 , 还需参考其他生物标志物的表达水平[7] 。
除此之外 , 有研究表明髓源性抑制细胞或特异性T细胞亚群与免疫检查点阻断(ICB)治疗后临床结果相关 。 PD-1抑制剂治疗后耗竭的循环T细胞重新激活 , 或可作为治疗中判断治疗反应的生物标志物[8] 。
肿瘤相关抗原(TAAs)NY-ESO-1或Melan-A在患者中普遍存在 , 且靶向这两种TAAs的T细胞已被证明与患者的临床结局相关[9] 。Kilian Wistuba-Hamprecht团队假设 , 外周血中NY-ESO-1和Melan-A反应性T细胞 , 或许可以作为预测转移性黑色素瘤患者对PD-1抑制剂治疗反应的生物标志物 , 并对此进行了研究 。
研究人员将患者分为发现队列(队列A)和验证队列(队列B) , 队列A纳入了72名接受帕博利珠单抗(n=35)或纳武利尤单抗+伊匹木单抗(n=37)治疗的IV期黑色素瘤患者 , 采集了ICB治疗前(BL)和接受治疗(FU)后的外周血样本 。 队列B包括39例接受帕博利珠单抗/纳武利尤单抗(n=11)或纳武利尤单抗+伊匹木单抗(n=28)治疗的IV期黑色素瘤患者 , 并采集了治疗前与治疗后的外周血样本 , 分别为39例和32例 。
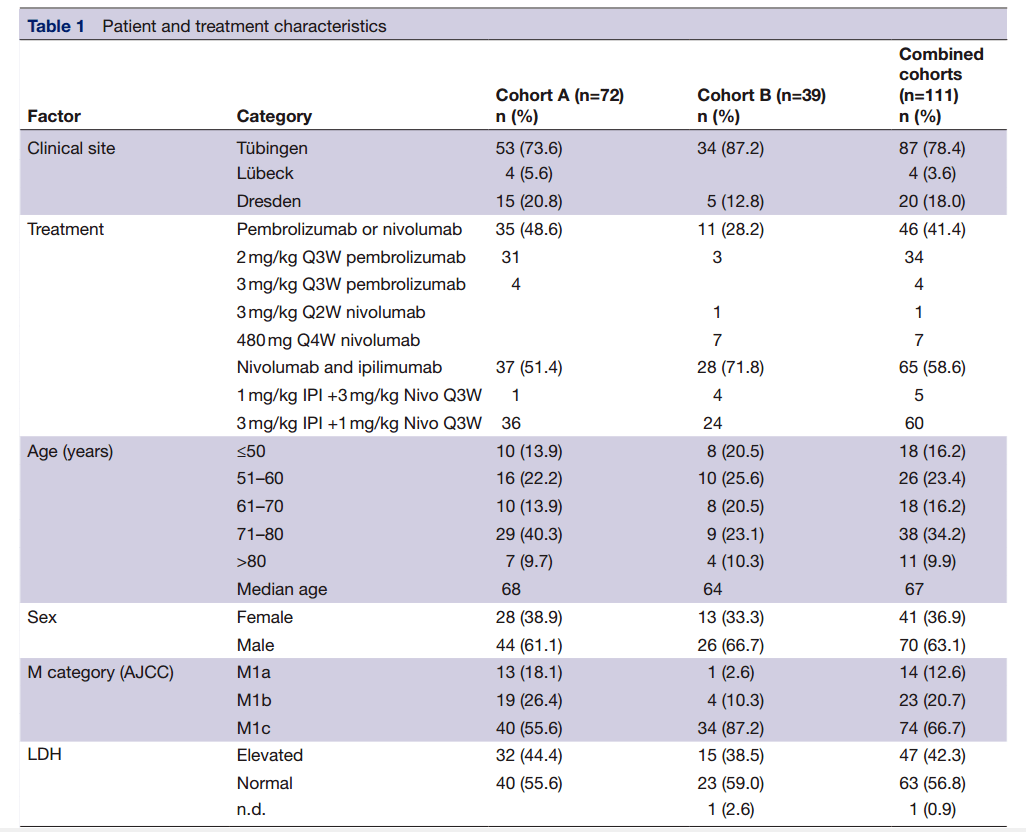
文章图片
患者临床特征
研究发现 , 接受ICB治疗前 , A组中57%的患者外周血中同时存在NY-ESO-1和Melan-A反应性T细胞 , 30%的患者仅有NY-ESO-1反应性T细胞 , 3%的患者只有Melan-A反应性T细胞 。 在验证队列B组中 , 77%的患者外周血中同时存在NY-ESO-1和Melan-A反应性T细胞 , 18%的患者外周血中仅有NY-ESO-1反应性T细胞 , 2%患者只有Melan-A反应性T细胞 。
接受治疗后 , A组15名患者(B组6名患者)外周血中NY-ESO-1-或Melan-A反应性T细胞消失 , A组中新发现13名患者(B组2名患者)可检测到TAAs反应性T细胞 。 此外 , A组与B组分别有22与24名患者治疗前后TAAs反应性T细胞未发生改变 。
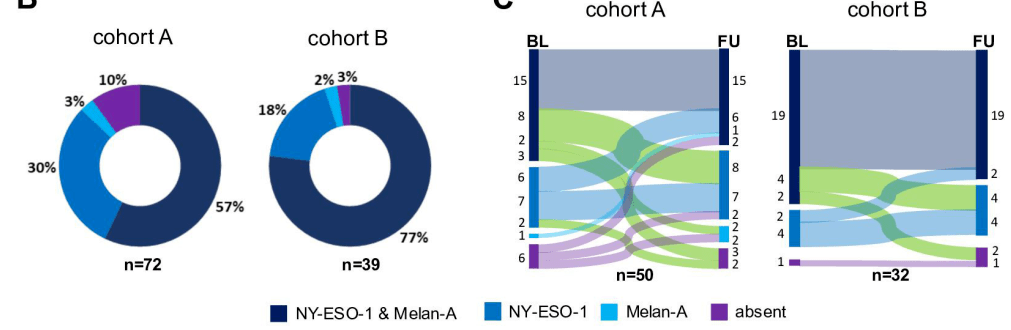
文章图片
患者外周血中TAAs反应性T细胞检测
接着Kilian Wistuba-Hamprecht团队分析了ICB治疗后肿瘤相关抗原反应性T细胞的早期改变是否与总生存期(OS)或无进展生存期(PFS)相关 。
- 山东省|【青岛六医】科室介绍——肿瘤内科
- 阳光|岳阳市中心医院启动肿瘤日间诊疗阳光行动
- 成都市肿瘤质控中心|市七医院召开2021年学科建设工作总结会暨成都市肿瘤质控中心工作总结会
- 肝脏恶性肿瘤,从1cm发展到5cm,需要多长时间?医生告诉你答案
- 癌症是省出来的吗?提醒:这四个坏习惯,希望你早点改
- 肾脏肿瘤|贫血太久,或是肿瘤信号!身体若出现4个异常,你该查查血了
- 三个意外的检查,发现六个早期癌症,这三个检查真的可以救命
- 不治之症|狗药能治疗癌症?癌症患者吃狗药都有用吗?研究告诉你真相
- 疾病|夺走一家三代人的性命:一种无法治愈的疾病,可能比癌症还可怕
- 癌症|晨读丨1月24日,关注健康每一天
