肝癌是最常见、也是最致命的消化道恶性肿瘤之一 。
然而 , 发病机制的不清 , 使得肝癌的治疗手段局限[1] 。 因此 , 迫切需要寻找肝癌发生发展过程中新的驱动分子 , 以研发更加有效的治疗方法 , 提高肝癌患者的预后 。
癌症—睾丸基因(CT基因)是原本仅仅在睾丸中特异表达的基因 , 但在肿瘤发生过程中被重新激活 , 也在肿瘤组织中高表达 , 驱动肿瘤的恶性进程[2] 。 肿瘤发生与精子发生的相似性 , 使得CT基因成为癌症潜在的驱动基因和富有希望的治疗靶点 。
近日 ,南京鼓楼医院肝胆胰中心孙倍成教授 , 联合南京医科大学生殖医学国家重点实验室胡志斌教授和南京大学医学院王守宇教授 , 发现一种新的CT基因 , 命名为 lnc-CTHCC , 并证实它在METTL3–IGF2BP1/IGF2BP3–lnc-CTHCC–hnRNP K–YAP1轴中发挥关键作用 , 导致肝癌的发生和发展[3] 。 研究成果在线发表在最新一期的著名医学期刊《自然·癌症》 。

文章图片
▲ 论文首页截图
首先 , 研究人员联合GTEx和TCGA数据库 , 从中发掘出一个新的基因 , 在睾丸中特异表达 , 同时也在肿瘤中高表达 。 经鉴定 , 它 符合CT基因的表达模式 , 同时也是一种lncRNA , 于是将其命名为lnc-CTHCC 。
接着 , 研究人员对lnc-CTHCC进行了检测 , 发现 lnc-CTHCC在肝癌的细胞株和临床样本中表达明显升高 , 且与肝癌体积、AFP水平、癌症分期和血管侵犯显著相关 , 还是影响肝癌患者预后的独立危险因素 。
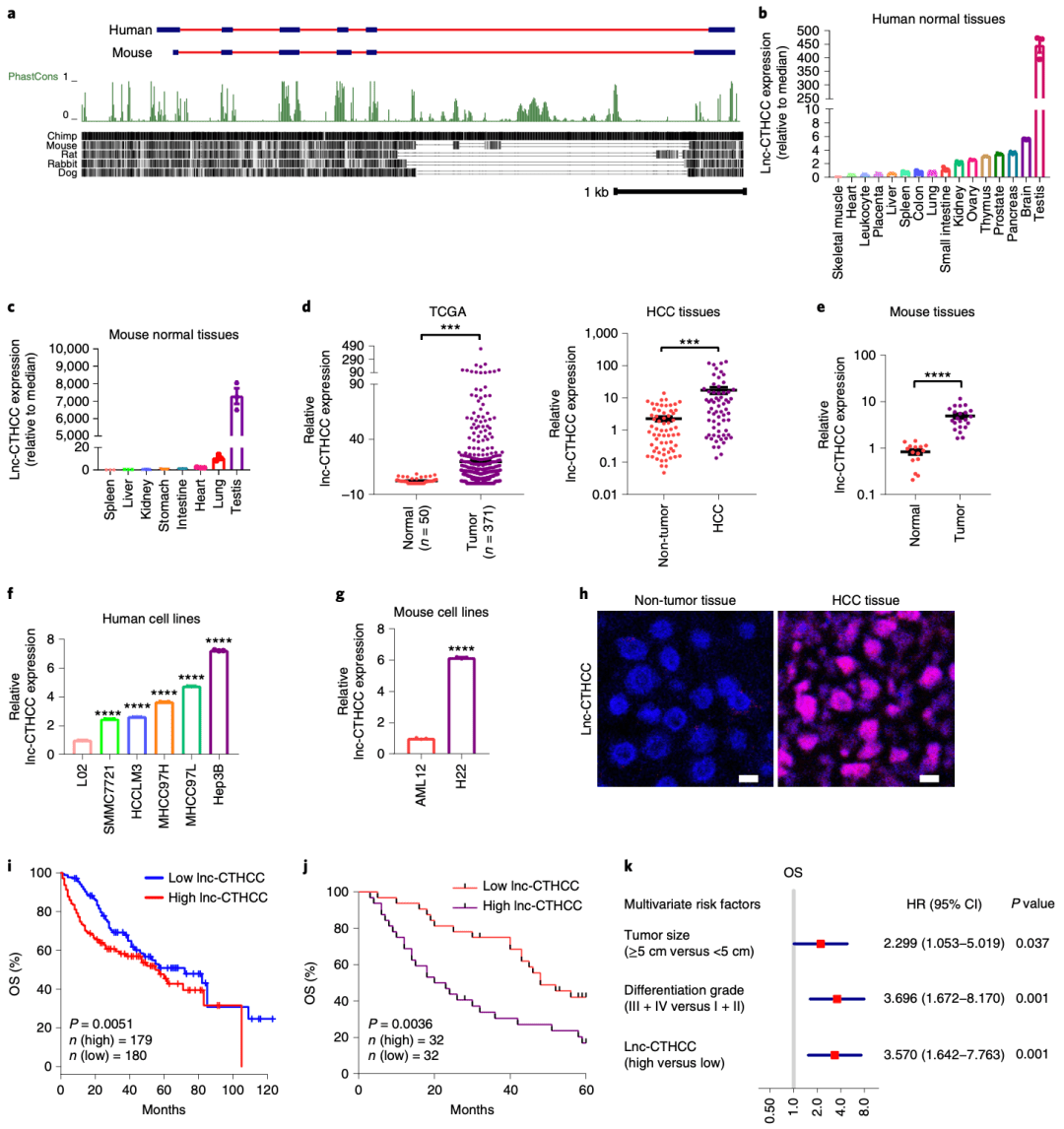
文章图片
▲ 正常情况下lnc-CTHCC只在睾丸中特异表达( 图b);lnc-CTHCC在肝癌细胞株(图f)和肝癌组织(图d)中高表达(HCC为肝癌 , L02为正常肝细胞株 , 其余5种为肝癌细胞株);lnc-CTHCC高表达和肝癌预后差(图j)以及临床病理特征(图k)相关 。
随后 , 研究人员进行了表型实验 , 探究lnc-CTHCC在肝癌发生中的作用 。
敲除lnc-CTHCC后 , 肝癌细胞的增殖、迁移和侵袭能力减弱 , 肿瘤血管生成减少;而过表达lnc-CTHCC , 则加快肝癌类器官生长速度 , 上调促血管生成因子的表达 。 细胞实验表明 ,lnc-CTHCC能促进肝癌的增殖、转移和血管生成 。
研究人员又构建了lnc-CTHCC基因敲除小鼠 , 然后诱导肝癌形成 。 结果发现 , 敲除lnc-CTHCC后 , 肝癌小鼠的瘤体质量和数量减小 , 肝脏炎症水平和纤维化程度下降 , 微血管密度降低 , 细胞增殖减弱和凋亡增多 , 肝癌肺转移被抑制 。 动物实验表明 ,lnc-CTHCC缺失能抑制肝癌的发生和发展 。
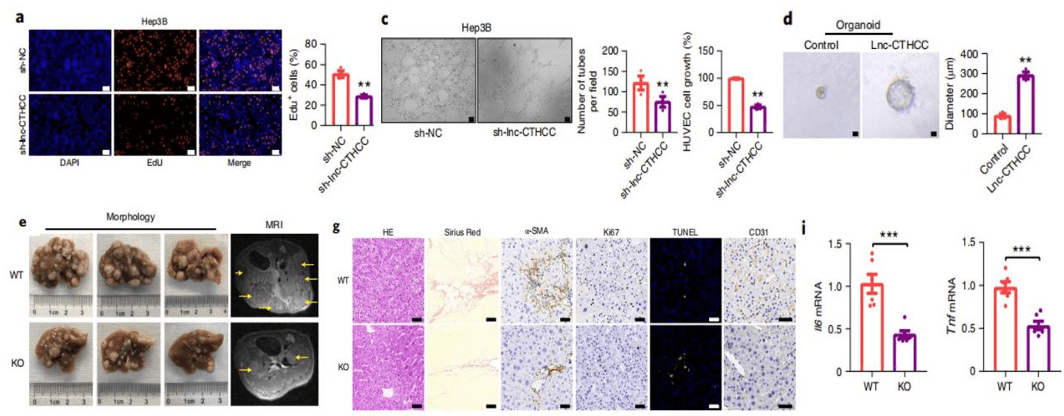
文章图片
▲ 敲除lnc-CTHCC后 , 肝癌细胞增殖减慢(图a) , 肿瘤血管生成减慢(图c);过表达lnc-CTHCC后 , 肝癌类器官生长加快;lnc-CTHCC敲除后 , 肝癌小鼠瘤体质量和数量减小(图e) , 肝脏炎症水平(图i)下降 , 微血管密度降低 , 细胞增殖减弱和凋亡增多(图g) 。
表型实验的成功让研究人员对lnc-CTHCC促进肝癌的分子机制进行了探究 。
考虑到ncRNA通常通过结合特定的蛋白质发挥功能[4] , 研究人员获得了与lnc-CTHCC直接结合的蛋白质 , 他们把目光锁定在了 hnRNP K上 。
hnRNP K属于RNA结合蛋白 , 也是一种转录因子 , 既往研究发现其表达的异常与多种肿瘤的发生密切相关[5] 。 于是 , 研究人员也在肝癌组织中进行了检测 , 发现 hnRNP K表达升高 , 而且与肝癌患者的预后差显著相关 。
- 杨女士|癌症治与不治都是死,不如花钱游山玩水肿瘤科主任说出了大实话
- 胰腺癌|癌症来临时,身体会“喊痛”!身上若出现5种痛,千万别大意了
- 从容|《2022安盛心理健康状况调研报告》:新冠疫情挑战为心理健康发展带来契机,健康意识和韧性均显著提升
- 绿茶|我们怕癌,但是癌更害怕它们,尽量多吃这3种食物,让癌症远离你
- 研究人员|喝茶不养生,还可能“养癌”?50万国人研究:喝茶与多种癌症有关
- 倾向|家族当中有几个近亲得了癌症,我们应该怎么做?
- 饮食|想要预防癌症,要在饮食上做出一定改变,提醒:3样食物尽量少吃
- 因素|焦虑男易患两大疾病
- 有“癌症抗体”的人,可能有这6个“共性”,你有吗?
- 癌症|孩子出现关节痛、瘀斑等症状,家长需警惕这种疾病
