文章图片
▲ PDX实验发现cirCDYL2与HER2阳性乳腺癌细胞产生曲妥珠单抗耐药有关
那到底cirCDYL2是怎么发挥作用的?为了找到这个问题的答案 , 研究者不得不抽丝剥茧 , 一步一步接近真相 。
首先他们发现 HER2与cirCDYL2之间没有直接的调控关系 , 其中一个分子的表达量变化 , 不会直接影响另一个分子 。 因此 , 他们推测cirCDYL2应该跟HER2相关的信号通路蛋白有相互作用 。
通过蛋白质体外结合实验、环状RNA下拉实验、免疫沉淀等实验结果 , 他们终于确定cirCDYL2与GRB7信号蛋白存在相互作用 。cirCDYL2是通过GRB7蛋白去促进HER2+乳腺癌细胞的曲妥珠单抗耐药 。
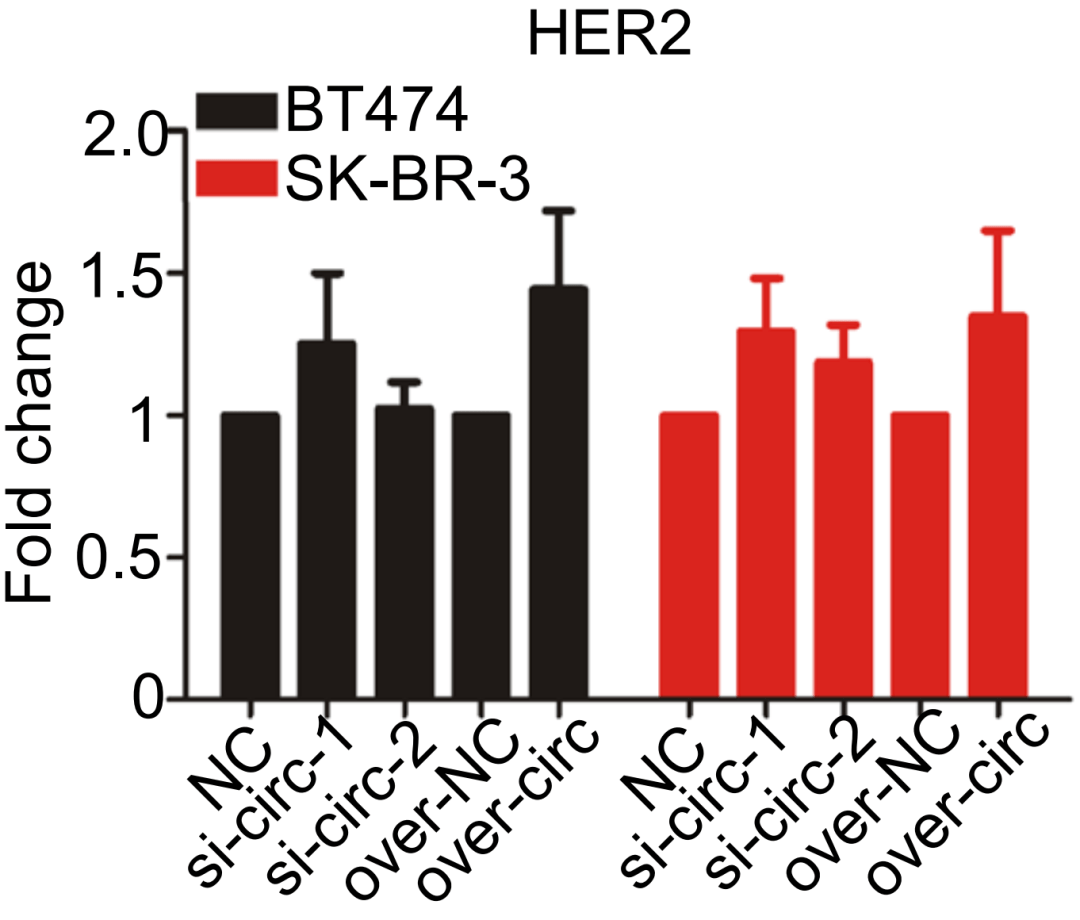
再进一步分析这两个分子之间的相互作用 , 他们发现cirCDYL2使GRB7蛋白变得稳定 , 但敲除cirCDYL2对GRB7的mRNA表达水平又没有显著影响 。 因此研究者们判断 cirCDYL2对GRB7的作用是发生在转录翻译之后 。
文章图片
▲ cirCDYL2使GRB7蛋白变得稳定
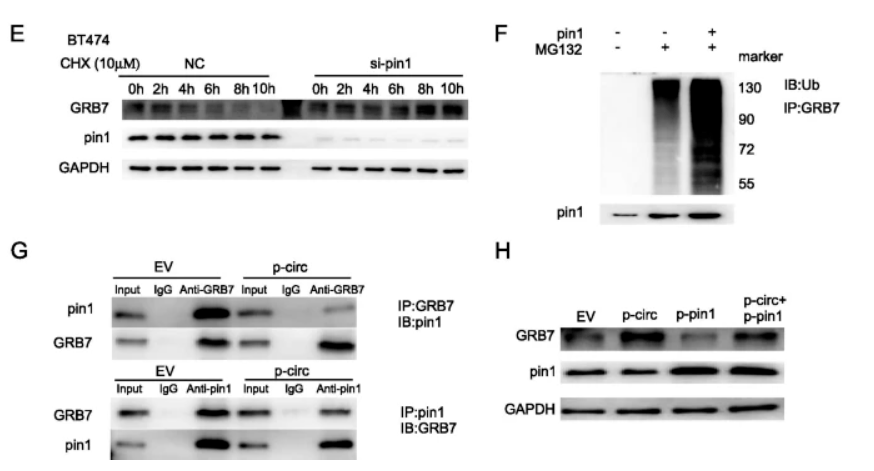
之前的研究已经发现 , GRB7可以通过泛素化完成降解[6] , 因此研究人员猜想cirCDYL2能影响GRB7的泛素化水平 。
随后他们发现 , 将细胞内的Pin1蛋白基因 (GRB7的稳定性的调控蛋白)敲除 , 可以增加GRB7蛋白的稳定性 , 转染Pin1会提升GRB7蛋白泛素化水平 。 免疫沉淀实验发现 , 过表达cirCDYL2可以在过表达Pin1的细胞环境下 , 提升GRB7蛋白稳定性 , 相比仅过表达Pin1的细胞 , 同时过表达cirCDYL2和Pin1的细胞有更多GRB7蛋白可以被沉淀下来 。
所以 ,cirCDYL2是通过干预Pin1蛋白来抑制GRB7的泛素化降解 , 导致GRB7的表达量上调 。
文章图片
▲ Pin1加剧GRB7蛋白降解 , CirCDYL2抑制Pin1维持GRB7蛋白稳定
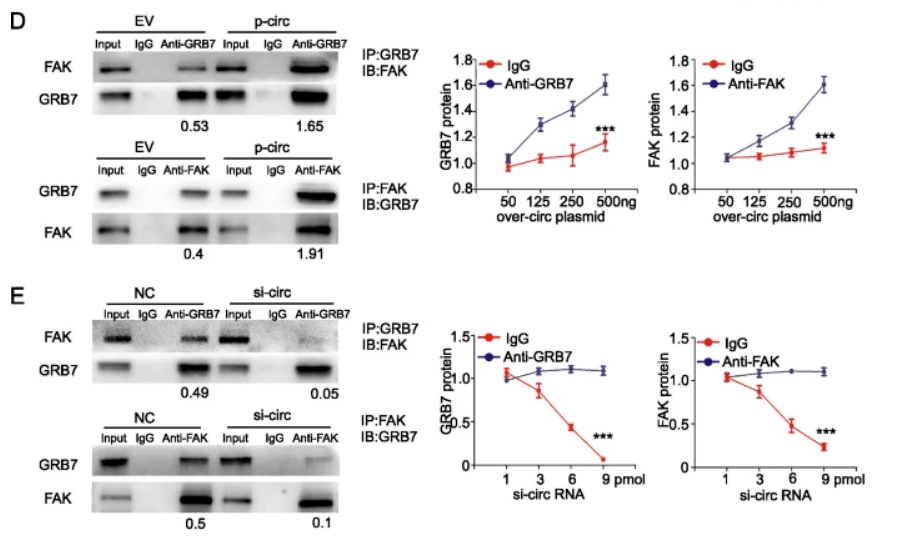
不过 , 也有研究表明 , GRB7只是一个衔接蛋白 , 是通过与FAK蛋白结合来维持AKT和ERK信号蛋白的磷酸化激活状态 , 进而促进HER2下游信号传导[7] 。
研究者们利用RNA结合蛋白免疫沉淀等实验发现 , FAK蛋白与circCDYL2存在相互作用 。 而且相比对照组 , 过表达cirCDYL2的细胞中 , 能够发现更多FAK与GRB7蛋白结合的现象 , 即 circCDYL2可促进GRB7与FAK结合 。
而将FAK沉默后 , 对曲妥珠单抗耐药的细胞中P-AKT和P-ERK变少了 , 这意味着耐药性减弱 。
这说明 cirCDYL2是通过FAK来促进HER2阳性乳腺癌细胞曲妥珠单抗耐药 。
文章图片
▲ circCDYL2-GRB7-FAK结合机制
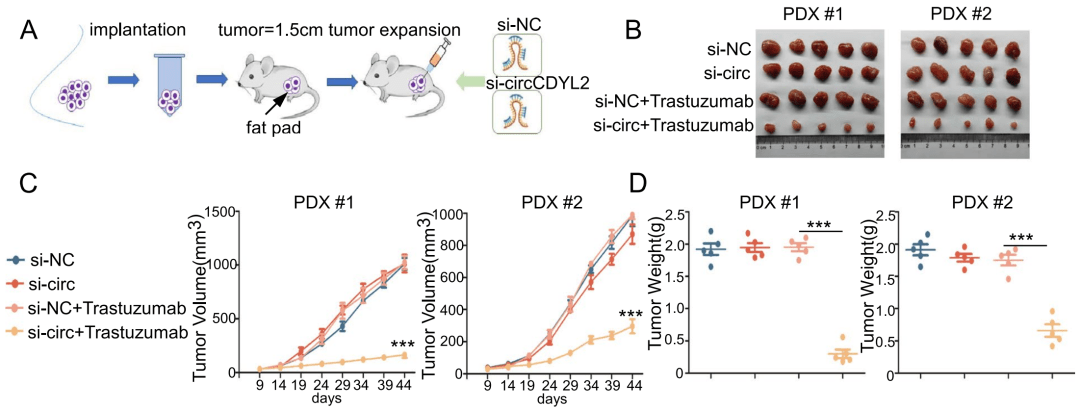
最后 , 研究者要在体内证明HER2阳性乳腺癌对曲妥珠单抗耐药确实与cirCDYL2-GRB7-FAK的作用机制有关 。
他们将SK-BR-3细胞改造成过表达cirCDYL2的P-SK-BR-3细胞和敲除cirCDYL2的SK-BR-3-R细胞 , 并原位注射到小鼠乳房脂肪垫 , 实验组小鼠一周注射两次曲妥珠单抗 , 44天后将肿瘤取出观察结果 。
结果发现 , 仅敲除cirCDYL2或者注射曲妥珠单抗这两种手段对已经耐药的肿瘤生长无明显影响 , 但在敲除cirCDYL2且注射曲妥珠单抗的实验组 , 肿瘤生长被显著抑制 。 这说明 敲除cirCDYL2可以逆转肿瘤对曲妥珠单抗的耐药 。
更有趣的是 , 使用FAK或者GRB7蛋白抑制剂干预 , 也可以达到敲除cirCDYL2类似的效果 。 即使是过表达cirCDYL2的肿瘤 , 使用FAK或者GRB7蛋白抑制剂也可以缓解曲妥珠单抗耐药 。
因此 ,cirCDYL2确实促进了曲妥珠单抗耐药 , FAK及GRB7蛋白抑制剂可缓解曲妥珠单抗耐药 。
- 有关|5名跨境货车司机核酸阳性!深圳口岸发布提醒
- 阳性|5名跨境货车司机核酸阳性!深圳口岸发布提醒
- 治疗|主任提问:GBS 阳性抗生素到底怎么用?用多久?青霉素、头孢都过敏怎么办?
- 证券时报网|深圳口岸:已连续发现5名跨境货车司机新冠肺炎核酸检测阳性
- 有关|2月4日至今 深圳口岸连续发现5名跨境货车司机阳性
- 检测|深圳:近期连续发现5名跨境货车司机核酸检测阳性
- 疫情|2月7日天津新增1例阳性感染者
- 阳性|广西本轮疫情已累计有确诊病例99例
- 阳性|广西本轮疫情已累计有确诊病例99例,均在百色市
- 阳性|河北疾控中心紧急提示:这些人请立即报备!另,三河市发布最新公告!
