我们之所以“谈癌色变” , 除了其难发现、易转移 , 还在于绝大部分抗肿瘤药物 , 最终都逃不过耐药的命运 。 狡猾的癌细胞会逃过药物的打击 , 卷土重来 。
乳腺癌是威胁女性健康的第一杀手 。 在乳腺癌患者中 , 约有15-20%为HER2过表达 , 即HER2阳性乳腺癌患者 。曲妥珠单抗是首个以HER2为靶点的人源化抗体药物 , 是HER2阳性乳腺癌临床的一线推荐用药 。
尽管曲妥珠单抗对HER2阳性乳腺癌有着突出疗效 ,仍有25-40%患者因为曲妥珠单抗耐药 , 后继出现癌症复发和转移[1] 。其他HER2靶向药物对原发性曲妥珠单抗耐药患者的作用甚微[2] 。
然而人们对曲妥珠单抗的耐药机制尚未完全了解 , 无法解决耐药难题 , 也没有有效的临床生物学指标帮助预测筛选这些对曲妥珠单抗耐药的患者 。
近日 ,中山大学孙逸仙纪念医院龚畅教授和李隽教授领衔的研究团队 , 在著名期刊 Molecular Cancer 上发表重要研究成果 。
他们 从曲妥珠单抗耐药的HER2阳性乳腺癌患者样本中 , 筛选出关键的环状RNA CDYL2(cirCDYL2) , 揭示了cirCDYL2-GRB7-FAK通路促进曲妥珠单抗耐药的原理 。
这个研究 弥补了临床预测曲妥珠单抗疗效和耐药的生物学指标空白 , 并为逆转曲妥珠单抗耐药提供了治疗思路[3] 。

文章图片
▲ 论文截图
环状RNA是细胞中一类特殊的非编码封闭环状RNA分子 , 科学家们发现这类分子在不同疾病和不同疾病进程上会表现出不同的特征 , 并广泛参与各类细胞活动[4] 。 已有许多研究发现它能调节恶性肿瘤细胞的增殖、转移 , 在包括乳腺癌的恶性肿瘤耐药中扮演关键角色[5] 。 而目前 尚未有人研究HER2阳性乳腺癌细胞中环状RNA与曲妥珠单抗耐药的关系 。
龚畅教授团队利用高通量测序技术 , 从对曲妥珠单抗耐药的HER2阳性乳腺癌患者的肿瘤样本中 ,筛选出特异性高表达的环状RNA分子cirCDYL2 。
通过分析127个接受过曲妥珠单抗治疗的HER2阳性早期乳腺癌患者的数据发现 ,高表达cirCDYL2的乳腺癌肿瘤 , 肿瘤的尺寸更大 , 淋巴转移能力和增值能力更强 , 复发率更高 , 患者的无病生存期及总生存期更短暂 。 同时 , cirCDYL2高表达的肿瘤中 , Ki67(肿瘤增殖相关蛋白)表达 , 磷酸化AKT(P-AKT)和磷酸化ERK(P-ERK)的量更高 。
【阳性|孙逸仙纪念医院团队破解HER2阳性乳腺癌对曲妥珠单抗耐药之谜】因此 , 他们推测 cirCDYL2与HER2阳性乳腺癌患者对曲妥珠单抗耐药有关 。
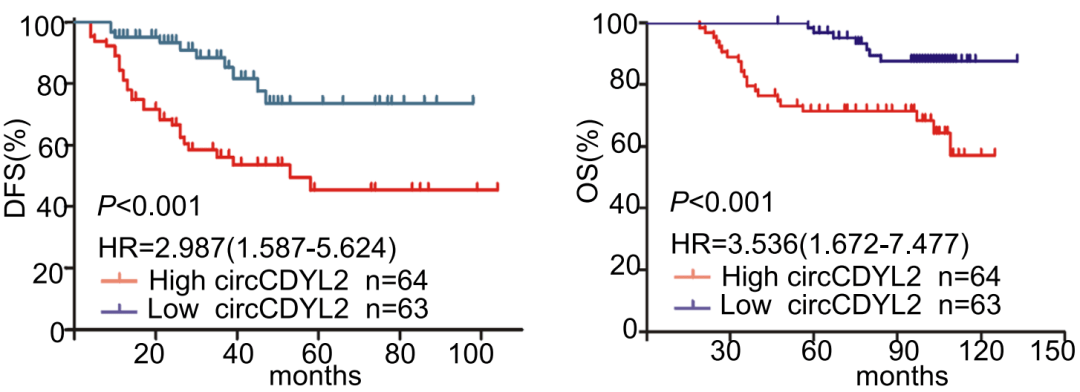
文章图片
▲ cirCDYL2表达shui水平与DFS和OS的关系
接下来 , 龚教授团队着手证明这个假设 。
他们用HER2阳性乳腺癌患者的癌细胞构建了人源肿瘤异种移植模型(PDX) , 通过连续4周瘤内注射小干扰RNA阻止cirCDYL2发挥作用(沉默) , 发现 cirCDYL2被沉默的实验组对曲妥珠单抗更敏感 , 肿瘤中的Ki67、P-AKT和P-ERK表达量都显著下降 。
为了从细胞层面研究cirCDYL2分子带来的变化 , 研究者构建了两个曲妥珠单抗耐药的HER2阳性乳腺癌细胞系SK-BR-3和BT474 。
沉默cirCDYL2后 , 虽然不影响两个肿瘤细胞系的凋亡 , 但肿瘤细胞的活力 , 迁移能力 , 形成克隆的能力都减弱 。 CirCDYL2的表达量下调也导致磷酸化AKT和ERK1/2的表达量下调 。 另一方面 , 实验还发现cirCDYL2的变化并不会影响HER2阴性的乳腺癌细胞增殖 。 这些实验结果说明 cirCDYL2与HER2阳性乳腺癌细胞的曲妥珠单抗耐药有关 。
- 有关|5名跨境货车司机核酸阳性!深圳口岸发布提醒
- 阳性|5名跨境货车司机核酸阳性!深圳口岸发布提醒
- 治疗|主任提问:GBS 阳性抗生素到底怎么用?用多久?青霉素、头孢都过敏怎么办?
- 证券时报网|深圳口岸:已连续发现5名跨境货车司机新冠肺炎核酸检测阳性
- 有关|2月4日至今 深圳口岸连续发现5名跨境货车司机阳性
- 检测|深圳:近期连续发现5名跨境货车司机核酸检测阳性
- 疫情|2月7日天津新增1例阳性感染者
- 阳性|广西本轮疫情已累计有确诊病例99例
- 阳性|广西本轮疫情已累计有确诊病例99例,均在百色市
- 阳性|河北疾控中心紧急提示:这些人请立即报备!另,三河市发布最新公告!
