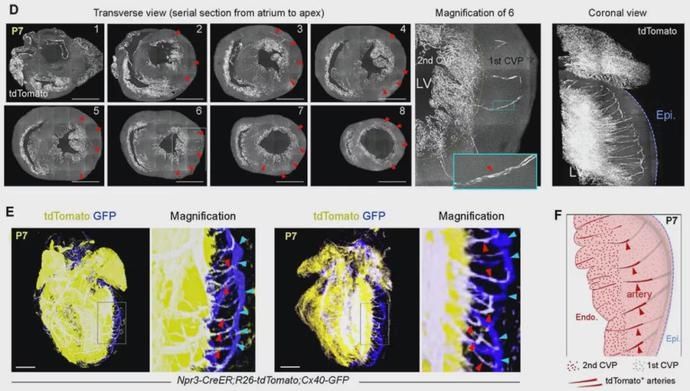
为了进一步阐明这种由心内膜来源内皮细胞向外侧心肌层迁移并形成的冠状动脉过程,研究者采用了荧光显微光学切片断层成像(fMOST)方法,对动脉形成过程进行了更为精细的完整心脏单细胞水平的成像。研究者将样本处理成1.0 μm厚度,然后用水镜进行成像。依据不同心脏大小,整个数据持续21-74小时,覆盖整个心脏的1700-5500张冠状面。数据经过一系列的处理重建,发现出生后5天的小鼠心脏心室壁外侧中出现前体冠状动脉索道,而出生7天后的心脏心室壁外侧中出现成熟的冠状动脉血管。研究者利用亚微米分辨率(0.320.321μm3)进行三维重建心脏的横向视图,可以清晰地看到形成冠状动脉的前体冠状动脉索道。为了进一步确认生成的是一群具有功能的成熟冠状动脉,研究者收集Npr3-CreER;R26-tdTomato;Cx40-GFP 心脏,通过fMOST成像可以清晰地看到前体冠状动脉索道生成的冠状动脉能连接1st 和 2nd CVPs,共同形成心脏的循环系统(如下图)。
文章插图
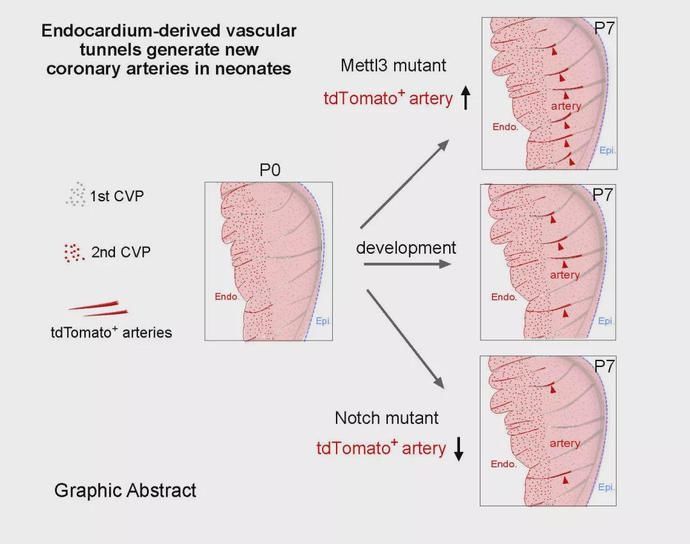
在分子机制方面,研究者通过一系列组织特异性基因敲除的遗传学方法,阐明了Mettl3和Notch信号通路可以调节前体冠状动脉索道的形成,从而调控着发育心脏中这一群特殊的冠状动脉数量。心内膜特异性Mettl3敲除后,心脏出现了更多的冠状动脉;而在Mettl3敲除基础上再敲除Notch信号通路Dll4或者Rbpj基因,心脏的冠状动脉形成明显减少,提示Mettl3-Notch信号通路调控心内膜来源的冠状动脉生产。进一步功能研究,研究者检测了这一群冠状动脉的心脏损伤修复中是否有作用,利用结扎冠状动脉左前降支构建了心肌梗死模型,发现心内膜来源的前体冠状索道生成的冠状动脉数量的增加和减少都会影响着心肌梗死后心脏功能的改变。
综上,研究者发现心内膜来源的前体冠状索道结构,可以经过动脉化后形成具有功能的冠状动脉,这一群冠状动脉连接出生后心脏的两个冠状血管群,而这一过程收到Mettl3和Nocth 信号通路的精细调控,同时这一群冠状动脉对成体心脏损伤后心脏功能的维持起着重要作用。
文章插图
中国科学院分子细胞科学卓越创新中心唐娟博士(现同济大学研究员)、博士生朱欢以及田雪莹博士(现暨南大学研究员)为该论文共同第一作者。中国科学院分子细胞科学卓越创新中心周斌研究员和海南大学骆清铭教授为该论文共同通讯作者。华中科技大学龚辉教授、牛津大学Nicola Smart教授、复旦大学附属中山医院颜彦教授、中国科学院分子细胞科学卓越创新中心童明汉研究员、西湖大学何灵娟研究员等也为该项研究提供了支持和帮助。

文章插图
原文链接:
- 芹菜|药物降压谨防四大误区
- 本文转自:天山网天山网讯(记者 王琦铭 通讯员 张桂萍 杨昌洪 报道)“这两朵花挤在一起...|胡小桃的“桃园”新春桃花朵朵开
- 本文转自:浙江日报浙江新闻客户端 共享联盟宁海站 徐铭怿 胡丹丹 仇丹娅 记者 陈醉2月...|宁海万亩西兰花抢收忙
- 郝铭鉴|涨知识!“福”和“褔”是同一个字吗?大部分人都错了
- 重症|怀匠医之心 铭责任担当——郑大一附院南院区心血管内科CCU开诊啦
- 本文转自:映象网信阳新闻映象网讯(大象新闻记者 吴彦飞 通讯员 袁志磊 徐铭)寒冬时节|信阳市浉河区董家河镇:村美民富产业兴
- 养生铭|万病源于堵!2个地方轻轻转一转:就能打通淤堵,疏通12条经络!
- 人气“四爷”何晟铭揭秘养心法
- 山东省抗癌协会|【“求卓路·医者心”系列报道③】王强:铭志肝胆 无畏挑战
- “精、气、神”三宝 看孙思邈的养生铭
