免疫检查点抑制剂(ICB)疗法主要包括抗PD-1和抗CTLA-4抗体治疗 , 近年来 , 它们延长了众多癌症患者的生存期 , 给他们带来了新的希望;但同时ICB治疗也具有较大的局限性和一系列副作用 , 这催促着全球科学家对其机制进行不断探索 。
对于ICB治疗 , 肿瘤内淋巴细胞的浸润是非常重要的一环 , 以往众多研究也已证明 ,肿瘤微环境中CD8+T淋巴细胞的存在跟ICB有效治疗紧密相关 。 但是它们究竟是如何通过血管进入肿瘤内部的 , 目前并不十分清楚 。
近日 , 来自法国图卢兹大学Jean-Philippe Girard课题组的研究人员在 Cancer Cell 期刊发表重要研究成果[1] 。 他们发现 ,肿瘤相关高内皮静脉(TA-HEVs)是介导淋巴细胞进入肿瘤的主要场所 , 提高TA-HEV内皮细胞(TA-HECs)的密度和成熟度能够促进肿瘤CD8+T细胞浸润 , 改善ICB疗效 , 而且 , TA-HEVs与黑色素瘤患者的ICB治疗效果密切相关 , 可以作为临床治疗有力的预测因素 。

文章图片
我们知道 , 肿瘤中CD8+T淋巴细胞的浸润是ICB治疗有效的关键 , 理清控制淋巴细胞聚集到肿瘤内的机制是至关重要的 。 目前更多研究偏重于对肿瘤血管限制淋巴细胞浸润的机制探索[2] , 相反 , 对肿瘤血管在促进淋巴细胞浸润这方面担任的角色了解甚少 。
因此 , Jean-Philippe Girard团队聚焦于TA-HEVs和TA-HECs , 希望能从这部分肿瘤血管更直观地探索出肿瘤免疫治疗过程中淋巴细胞进入肿瘤内部的分子机制 。
Jean-Philippe Girard团队选用了甲基胆蒽(MCA)诱导的小鼠纤维肉瘤模型 , 他们发现 在免疫缺陷小鼠上诱导的肿瘤移植到野生型(WT)小鼠后会发生自然消退;然而在WT小鼠上诱导长出的肿瘤移植到新的WT小鼠后会继续生长 。
他们在这两种肿瘤的血管中均观察到TA-HECs , 不过两者也有一些差异 ,在会自然消退的肿瘤模型中MECA-79+ TA-HECs占比更高 , 肿瘤相关非高内皮静脉内皮细胞(TA-EC)占比较低 , 而且 处于增殖状态的CD8+ T细胞更多 。
MECA-79+ TA-HECs在两种肿瘤中的表达与占比
那么 , TA-HECs在基因表达上具有什么特点呢?跟其他的血管内皮细胞有什么不一样呢?Jean-Philippe Girard团队进行了非常全面的分析比较 , 他们对比了淋巴结中的稳态HEC (LN-HECs)、炎性HEC(iLN-HECs)和非HEC(LN-ECs)以及肿瘤中的TA-HECs和TA-ECs 。
转录组RNA测序结果显示 ,跟其他内皮细胞相比 , TA-HECs具有非常明显的特点:①TA-HECs表达毛细血管后微静脉的marker基因(Ackr1等) , 表明TA-HECs起源于毛细血管后微静脉;②TA-HECs下调表达内皮细胞阻碍T细胞归巢的相关基因(Ednrb等);③TA-HECs表达更多炎性相关的基因(Selp , Sele等);④相对于淋巴结中的HEC , TA-HECs表达更低的Ltbr相关成熟HEV基因;⑤TA-HECs表达炎性趋化因子(Cxcl9 , Cxcl10)以及黏附分子(ICAM1 , ICAM2和VCAM1) 。
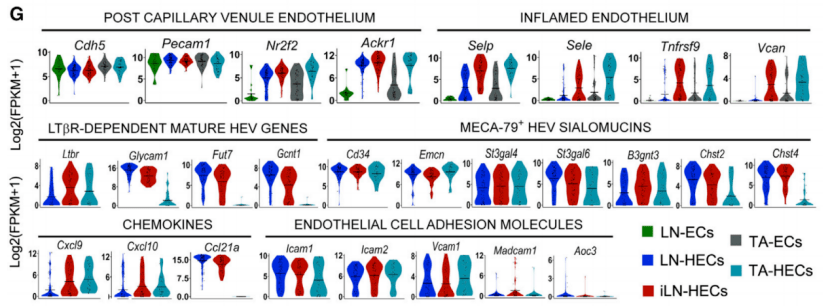
文章图片
各组血管内皮细胞的转录组RNA测序结果
总的来说 ,TA-HECs的表型十分独特 , 相比于TA-ECs , TA-HECs特异性表达MECA-79 , 而且表达更多的内皮选择素;相比于LN-HECs , TA-HECs则具有更不成熟的HEV表型 。
既然TA-HECs表达高水平的选择素 , 那么T细胞和TA-HECs之间是什么关系呢?
首先 , 该团队对荷瘤小鼠进行CD4+T或CD8+T细胞的体内清除 , 发现只有当肿瘤内CD4+T细胞被清除时 , TA-HECs也几乎没有了!这说明 CD4+T细胞对TA-HECs的存在十分关键 。 而且ICB (抗CTLA-4+抗PD-1抗体)联合治疗后 , 发现肿瘤中TA-HECs的占比显著提高;同时ICB治疗促进了肿瘤内CD4+和CD8+T细胞浸润和增殖 , 提高了干细胞样CD8+T和耗竭型CD8+T细胞的比例 , 降低了Treg细胞浸润 。 而且 以上ICB的治疗效果依赖于肿瘤内CD4+T细胞 。
- 高燕菁|20220319《健康加油站》预告:春季养生巧喝茶。
- 有没有小伙伴喜欢看《知否知否应是绿肥红瘦》的小伙伴|雪媚娘,比店里的好吃,比店里的料足!
- 隔离|《新冠病毒抗原检测应用方案(试行)》 印发 14个新冠抗原检测试剂已获批
- 药品|《中药材生产质量管理规范》正式发布实施
- 疫情|《新闻1+1》丨对话邬惊雷:上海疫情如何“精准防控”?
- 《第一书记》牵线,双村合璧种好菜!
- 影响|天士力医药集团股份有限公司关于公司藿香正气滴丸等产品列入 《新型冠状病毒肺炎诊疗方案(试行第九版)》的公告
- 细胞|这些指标读不懂 体检算是白做了
- 细说说覆盆子(树莓)的功效与作用及食用方法
- 抗原|国务院应对新型冠状病毒肺炎疫情联防联控机制综合组印发《新冠病毒抗原检测应用方案(试行)》
