难题|癌症“克星”来了,但商业化是个难题( 二 )
研发井喷,市场乐观
对于CAR-T这一新兴疗法,海外热闹非凡,国内企业也在马不停蹄追赶,研发热情极高,临床试验数量呈井喷态势。
根据毕马威统计,截至2020年底,我国有335个正在进行的CAR-T临床试验,进展较快的包括复星凯特、药明巨诺、传奇生物、合源生物、科济生物等,涉及的靶点包括CD19、BCMA、CD4等血液肿瘤靶点以及Claudin18.2、GPC3、MSLN等实体瘤靶点。
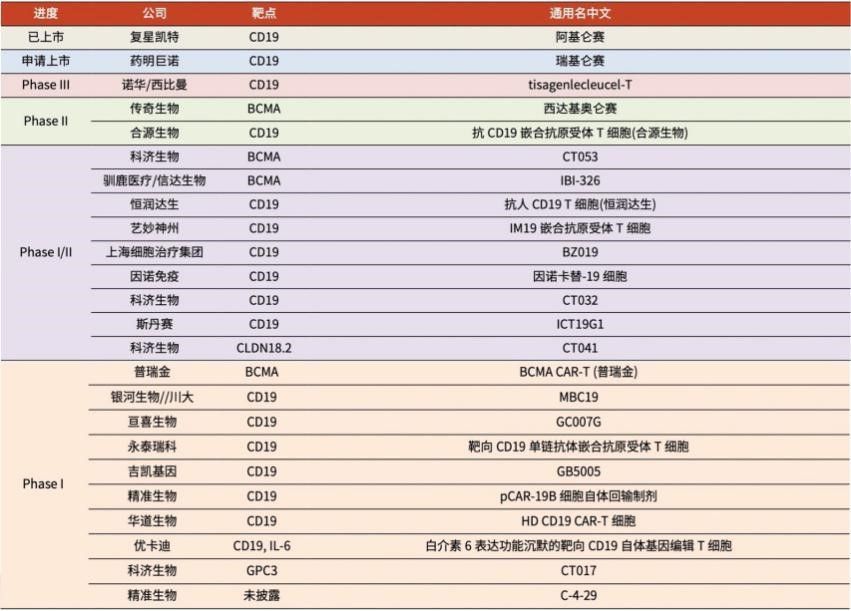
文章插图
▲截至2021年6月23日,国内CAR-T疗法临床研发进展(资料来源:光大证券研报)
虽然我国临床试验数量已经超过美国,位居全球第一。,但从上市进程来看,还是晚于美国。
此次国内首款上市的CAR-T产品阿基仑赛注射液来自复星凯特,是对已上市产品美国Kite公司Yescarta的引进。从2017年初授权引进到如今在国内获批上市,历时4年多。
另一家企业药明巨诺旗下的CAR-T产品瑞基仑赛注射液,已经于2020年6月在国内提交上市申请,业内预计今年也将获批上市。
不过,即便如此,“能够获批上市”本身也给足了产业从业者及资本方乐观的预期。
“国家药监局批准首款CAR-T产品上市,对我国细胞和基因治疗产业绝对是一大利好。”北京大学免疫学系客座教授、贝赛尔特生物技术董事长兼首席科学家许中伟告诉《财经国际周刊》采访人员。
在他看来,一方面,这个先例从法律法规层面坚定了“细胞可以成药”的信念,接下来,越来越多的国内本土化CAR-T产品有望不断涌现;另一方面,广大癌症患者尤其是晚期癌症患者有了新的治疗选择并从中获益,对医生而言,也多了一种治疗手段。
中源协和细胞基因工程副总经理兼首席科学官张宇认为,CAR-T可以说是诸多细胞疗法中技术、工艺、质控最为复杂的,既然能成功按照药物上市,那么此前一直困扰行业的“细胞药物能不能做”问题已经不复存在,随着越来越多的细胞药物在中国获批上市,国内一直争论的细胞疗法按照药物监管还是技术监管的问题,也会迎刃而解。
南京新医药与生命健康产业创新联盟首席顾问马璟也表示,从新药上市全链条来说,细胞治疗最后一公里已经打通,接下来,后续产品只要研发符合安全有效、质量可控的原则,就上市有望。
不过,许中伟也提醒后续产品研发企业,一方面,CAR-T产品的技术壁垒高、工艺复杂,相关企业不能太过冒进,一定要先积累经验;另一方面,目前国内CAR-T产品研发,已经出现部分靶点如CD19扎堆的情况,在进入这一领域之前应客观评估未来的市场空间和企业的盈利空间。
商业化应用“拦路虎”
获批上市固然令人振奋,但CAR-T产品接下来的商业化应用道路并不好走。
“此前CAR-T产品主要的挑战来自于技术、工艺、临床层面,接下来这个领域的挑战将转移到商业化层面。”张宇认为,如何有效开发CAR-T产品的商业价值,惠及更多患者,是一个很大的挑战。
高昂的定价就是一大拦路虎,令许多有临床需求的患者望而却步。
不同于标准化、可量产的传统药物,CAR-T产品的治疗过程属于“私人定制”,即从患者体内分离出免疫细胞,经基因编辑、修饰或其他处理后,再回输给该患者。也就是说,要给每个患者生产一个批次的药物,靠传统药品规模化降成本的路径走不通。
因此,定制化的生产流程,加上复杂的生产工艺,让这类产品的开发成本较高,市场定价也居高不下。
从海外情况看,根据浙商证券研报,CAR-T定价除日本(30.5万美元)外,均处于36.5万~47.5万美元之间,创下多国单药价格获批最高纪录。而且,这只是药品价格,如果加上其他管理/监控成本、护理费用、副反应管理及化疗用于淋巴细胞清除等预处理费用,经估算,CAR-T疗法实际花销或为本身药品定价的1.65倍。
- 红豆|四九寒天,少吃大鱼大肉,多吃这6种“根菜”,补足营养健康过年
- 口味|给孩子做个“快手菜” 营养丰富,口味独特,提高身体的免疫力
- 潜伏在我们身边的这3种“致癌”蔬菜,看完你还敢继续吃吗?
- 穆罕默德|伊朗首次通报“奥密克戎”感染者死亡病例
- 鲁南制药集团|菏泽医学专科学校“鲁南制药产业学院”揭牌
- 进行|尿毒症多半是“吃”出来的?3种食物尽量少碰,肾或许“感谢”你
- 生活|提醒:肝病多数是“拖”出来的,出现6种表现,最好查一下肝功
- 羊肉|羊肉到底是“致癌杀手”还是“营养佳品”呢?世卫组织揭晓答案
- 心脑血管|大荔中医医院脾胃肺病科“妙手回春”受到患者的称赞
- 心血管疾病|这个病还是“夫妻病”,你知道吗?
