pegIFN|在研乙肝新药REP2139,HBV/HDV合并LC,可实现良好高效性
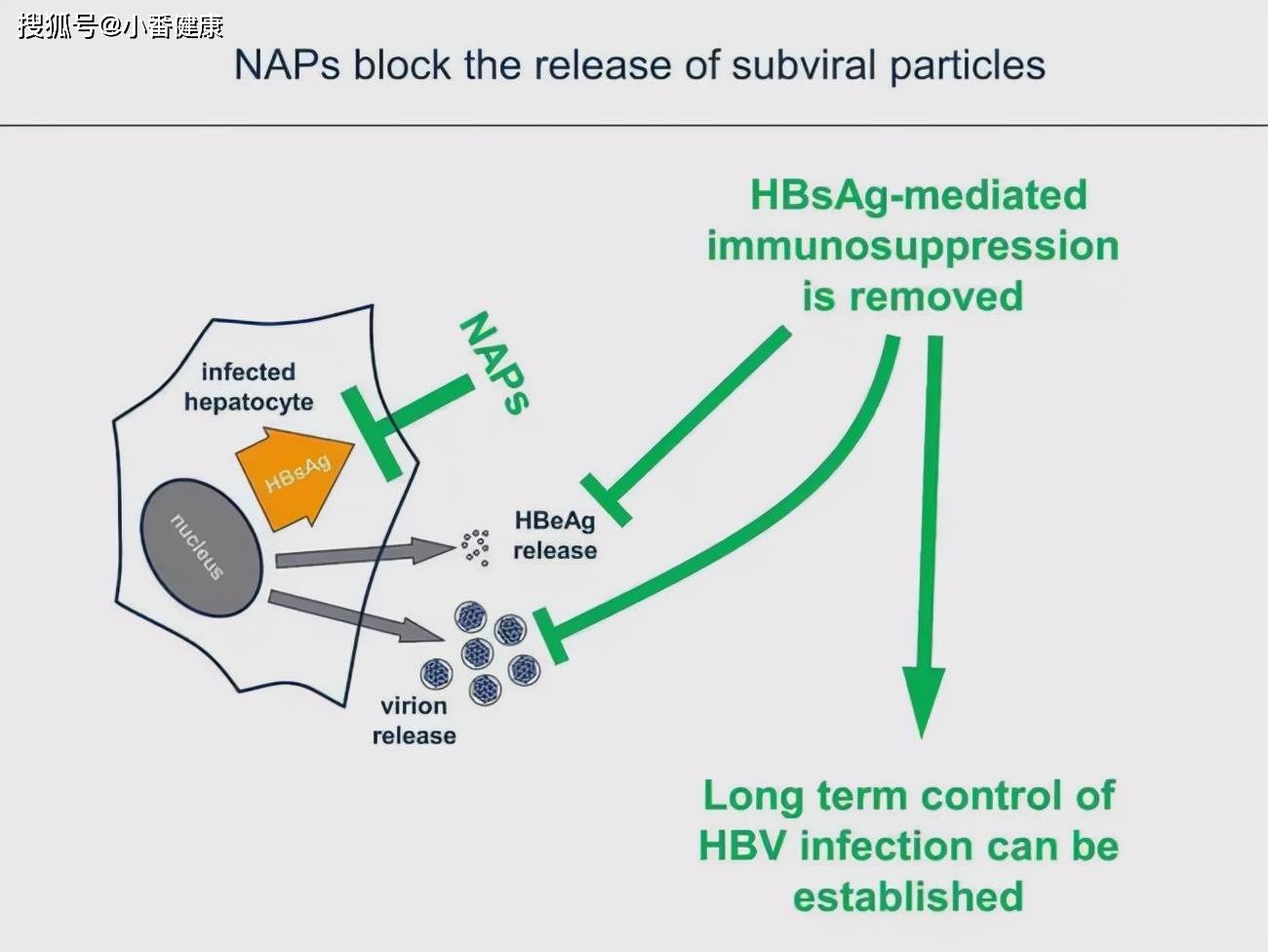
2021年美国肝病研究年会(AASLD2021)上 , 研究人员带来了基于核酸聚合物(NAP)在研乙肝新药REP2139相关研究进展 。 作用机制方面 , REP2139可选择性靶向非传染性乙肝病毒的亚病毒颗粒组装或分泌 , 进而阻止乙肝表面抗原从感染性肝细胞释放 。

文章图片
在研乙肝新药REP2139 , HBV/HDV合并LC , 可实现良好高效性
一、研究背景
今年美肝会上 , 带来的这项研究主要是在乙肝合并丁肝病毒感染的肝硬化(LC)患者中进行 。 研究人员介绍 , 当每周静脉输注时 , 基于 REP2139-Mg 的联合疗法可实现乙肝表面抗原(HBsAg)高消失率、治疗性转氨酶发作以及HBV和HDV的功能性治愈 。
与所有硫代磷酸寡核苷酸(反义寡核苷酸)一样 , REP2139 的皮下 (SC) 注射部位反应很常见 , 但与所有NAP一样 , 由于其长度增加 , 反应强度明显更高 。 NAPs (REP 2139-Mg) 的螯合物复合制剂可中和给药反应性 。
二、研究方法
研究在慢性HDV/HDV合并感染的肝硬化患者中 , 评估了皮下注射REP 2139-Mg 联合治疗的安全性和有效性 。 患者(男性 , 塞内加尔人 , 51 岁)自 2005年确诊为肝硬化和慢性HBV/HDV 合并感染(HDV GT3) , 之前使用富马酸替诺福韦二吡呋酯(TDF)(300mg)+pegIFN(180ug)治疗失败 , 后来使用 TDF+治疗失败 。 pegIFN (180ug) + bulvertide (2mg) , 目前仅接受TDF 。
停止 pegIFN + bulvertide 八个月后 , TDF 治疗补充了 90ug pegIFN 和 250mg REP 2139-Mg , 每周两次皮下注射 125mg 。 安全性评估包括肝、肾和血液学功能 。 病毒学评估包括 HDVRNA(Robogene MK II)、HBVDNA(Abbott)、HBsAg 和抗 HBs(Abbott Architect 定量) 。
文章图片
三、研究结果数据
结果表明 , 在前9周内未观察到REP2139-Mg 注射部位疼痛或炎症的迹象 。 此后 , 出现短暂的注射后轻度至中度不适 , 不伴有炎症 。 6周后的轻度瘙痒对支持疗法反应良好 。 两次轻度和浅表硬结不伴有疼痛或炎症 。 病毒学反应迅速 , 第4周HDVRNA检测不到 , 第15周HBsAg 变为 < 0.05 IU/mL , 第12周出现明显HBsAg血清学转换!
第6周后 , 出现强烈的宿主介导的转氨酶升高(ALT、AST和GGT) , 第9周达到最低点(ALT 373 U/L)并迅速恢复正常(当前ALT在第 16 周为 54 U/L) 。 整个治疗过程中 , 肝肾功能保持正常水平 , 血液学参数(RBC、WBC、血小板)稳定 。
文章图片
四、研究结论
研究人员给出的结论是 , 皮下注射REP2139-Mg+TDF+低剂量pegIFN (90ug) 联合用于HBV/HDV感染的肝硬化患者后 , 具有良好安全性、耐受性和高效性 。 治疗性转氨酶发作与任何不良反应无关 , 并且与HBsAg消失相关 。
【pegIFN|在研乙肝新药REP2139,HBV/HDV合并LC,可实现良好高效性】小番健康结语:从作用机理上 , 其实REP2139是一款设计作为抑制乙肝表面抗原释放 , 或称其为了阻止血液中乙肝表面抗原的补给 , 来降低肝细胞内表面抗原 。 当然 , 在2021年美肝会上 , 研究人员带来的是在乙肝合并丁肝的肝硬化患者中使用REP2139的研究 , 并评价在这类人群中的药物安全性和耐受性 , 而不是仅单纯对慢性乙肝感染受试者 。 可以将这款候选药物称为表面抗原抑制剂 。
- 潜伏在我们身边的这3种“致癌”蔬菜,看完你还敢继续吃吗?
- 健康生活 薯条一个月最多吃两次
- 亿健H7|冬天户外空气差,不妨在家动起来!——亿健H7智能磁控划船机体验分享
- 猪油渣能不能吃?健不健康?很多人都不明白,现在知道还不晚
- 护发|吃“猕猴桃”好处多多,但有3类人不能多吃,现在知道还来得及!
- 检测|刚刚,溯源结果公布!在国际快递中检测出阳性
- 亚硝酸盐|你真的会喝水吗?喝错水的人不少,4个错误你还在犯吗?
- 水果|过年水果选哪些?这些优质年货,在你的购物清单上吗?
- 中国雄安官网1月14日电(李元闯)在雄安新区安新县|家乡雄安丨杨宏记:村民致富路上的“带头人”
- 医保|昔日近70万一针的诺西那生钠注射液纳入医保 “天价药”在临沂打出第一针
