肿瘤免疫治疗在癌症治疗中显示出巨大的前景 , 不仅是2013年《科学》杂志评选的年度最重要的科学突破 , 美国科学家詹姆斯·艾利森和日本科学家本庶佑也因相关研究获得2018年诺贝尔生理学或医学奖 。
肿瘤免疫治疗主要包括免疫检查点抑制剂、细胞治疗、肿瘤疫苗等 。 遗憾的是 , 在临床应用中 ,只有一小部分晚期癌症患者对免疫检查点抑制剂单药治疗有反应 。 为了提高免疫治疗的有效性和患者反应率 , 需开发新的治疗方案 。
中山大学刘新建教授团队 开发出一种PI3K/HDAC双抑制剂(BEBT-908) , 可以通过诱导铁死亡有效抑制肿瘤细胞增殖 , 并增强抗PD-1治疗的效果[1] 。
这一研究最近发表于 Cancer Research 上 。
文章封面
PI3K和HDAC信号通路是影响人类恶性肿瘤的两个重要信号通路 , 也是药物开发的重要靶点[2-3] 。HDAC抑制剂(HDACi)与PI3K-AKT-mTOR通路抑制剂联合使用的策略 , 在临床前和临床研究中都显示出了良好的抗肿瘤作用 , 药物联合使用也克服了单一用药的耐药等问题[4-6] 。
基于以上研究刘新建团队猜测:同时抑制HDAC和PI3K通路可能更有效地抑制肿瘤细胞的生长 , 并能更好地与免疫检查点抑制剂发挥协同作用 。
因此 , 他们合成并优化了一系列PI3K/HDAC双抑制剂 , 其中 BEBT-908在明显抑制PI3Kα激酶的同时 , 也可显著抑制HDAC1、HDAC2、HDAC3、HDAC10和HDAC11 。
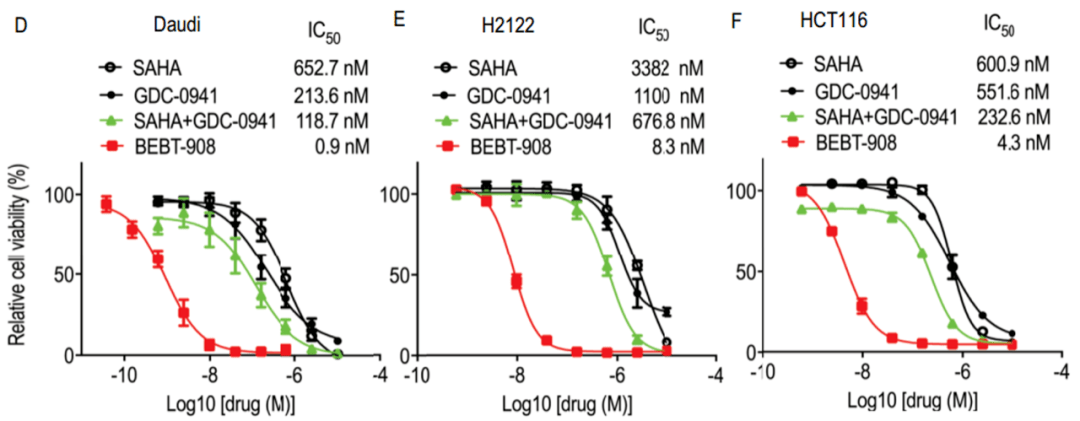
刘新建团队首先在体外试验中验证了这一药物的作用 。 在人Burkitt淋巴瘤Daudi细胞、非小细胞肺癌H2122细胞、结直肠癌HCT116细胞中 ,BEBT-908的作用显著高于PI3K抑制剂(GDC-0941)和HDAC抑制剂(SAHA)单独或联合使用 。
BEBT-908可以显著抑制PI3K信号通路下游AKT和4EBP-1的磷酸化 。 此外 , 在P53野生型或P53突变型肿瘤细胞中 , BEBT-908都以剂量依赖的方式诱导组蛋白H3、微管蛋白和P53等蛋白的超乙酰化 。 激酶谱选择性试验显示 , BEBT-908脱靶激酶活性较低 。 表明 PI3K/HDAC双抑制剂BEBT-908是一种特异性强且高效的抗癌药物 。
文章图片
新型PI3K/HDAC双抑制剂BEBT-908能有效抑制肿瘤生长
刘新建团队接着对DMSO、BEBT-908、SAHA+GDC-0941联合治疗后的肿瘤细胞进行了RNA测序 , 以探索BEBT-908治疗后细胞转录组的改变 。 他们发现 , 与DMSO相比 , 药物联用(SAHA+GDC-0941)和BEBT-908干预后基因表达均有明显改变 。 有趣的是 , SAHA+GDC-0941处理的细胞与BEBT-908处理的细胞在基因表达上有很大差异 ,BEBT-908处理的细胞显示出P53信号通路、铁死亡和谷胱甘肽代谢的显著富集 。
这一发现让刘新建团队 将研究重点聚焦在铁死亡上 。
铁死亡是一种有别于凋亡的细胞程序性死亡方式 , 主要特征为铁依赖性脂质过氧化物积累 , 目前的研究已经发现铁死亡与多种疾病发生发展相关 。 在本研究中 , 研究人员发现 BEBT-908可以诱导P53第370位点的赖氨酸高度乙酰化 , 这一改变可能使癌细胞对铁死亡敏感 。
为了验证BEBT-908的肿瘤抑制作用是否与铁死亡相关 , 研究者在DMSO、SAHA+GDC-0941、BEBT-908和Erastin处理的细胞中 , 分别检测了两种关键的铁死亡调控因子SLC7A11和GPX4的表达 。 既往研究显示 , 抑制SLC7A11或GPX4的表达均可以促进铁死亡的发生 。
结果表明 , 在HCT116细胞系中 , BEBT-908处理显著抑制了SLC7A11和GPX4的表达 。 此外 ,BEBT-908处理可抑制铁死亡负调控因子NRF2的表达 。 在BEBT-908处理的HCT116细胞中 , 铁代谢相关基因(TRFC , Keap1和NOXO1)上调 , 氧化还原谷胱甘肽代谢相关基因(GCLM)下调 , 细胞中可见脂质活性氧(ROS)和脂质过氧化的产物丙二醛积累 。
- 人员|我国面临德尔塔奥密克戎双重挑战
- 肾精亏虚?补肾的方子中有两味中药可以泡水,阴阳双补,轻身不老
- 大桥|18日0时起,港珠澳大桥穿梭巴士港珠线双向暂停运行
- 防控|18日0时起,港珠澳大桥穿梭巴士港珠线双向暂停运行
- 赤溪镇|苍南赤溪:助力“双减”,“为eye护航”活动
- 双下肢|中国家长最喜欢的兴趣班,却没人提醒你它有多危险!
- 考试|“双减”后首个期末考试不该再现“聪明药”
- 家属|医生因家属放弃手术哭红双眼:不救可叹,生死抉择从来都很现实
- 男子|气到中毒?男子与女友吵架,吵到四肢僵硬倒地、双手痉挛、呼吸困难…...
- 传播|动解 | 冬季流感与新冠叠加传播风险增高,怎样预防双重感染?
