他汀类药物(Statins , 下文简称他汀)常被用于预防心脏病发作(Heart Attack)或中风(Stroke) , 能够降低血液中的胆固醇水平 , 40岁以上人群中平均每4人中就有1人服用此类药物 。
就是这样一类药物 , 在胰腺癌的治疗中表现出了另一番功效——抗癌 。 有研究结果显示 , 在服用他汀 超过4年的患者中 , 胰腺癌的风险值降低了80%;且他汀药物与胰腺癌患者生存率升高有关[1] 。
作为控制心脑血管疾病的常用药物 , 他汀又是如何具备抗癌功效的呢?难道他汀还有其他未知功效吗?
【细胞|《细胞》子刊:他汀“两面三刀”,癌细胞“游移不定”】事实上他汀还有增强癌细胞转移的能力 , 这项能力恰恰给予了它抗癌的技能 。
近期 , 来自杜伊斯堡-埃森大学和斯坦福大学的研究人员在《细胞报告》杂志发表论文[8] , 他们发现 ,他汀能够通过调节癌细胞的可塑性(cellular plasticity)来控制癌细胞的发展及转移 。 具体地说 , 他汀提高了癌细胞的转移能力但却降低了其定殖能力 。
那么这其中的分子机理包括哪些呢?让我们随着研究人员来一探究竟 。

文章图片
论文首页截图
细胞可塑性对于癌细胞的发生、转移、定殖至关重要 , 其中上皮细胞与间充质细胞形态之间的互相转化(Epithelial-to-mesenchymal transition, EMT和Mesenchymal-to- epithelial, MET)是癌细胞完成上述过程的关键两步[2, 3] 。
临床上的许多药品可能都具有影响细胞可塑性的能力 , 那么这些药品中对细胞可塑性影响较大的有哪些呢?为什么他汀会被列为该团队的研究重点呢?
事实上 , 在前期的实验中 , 研究团队使用了体内复合小分子筛库平台对FDA批准的624类药物进行了筛选 ,氟伐他汀(Fluvastatin)作为得分较高的候选药物进入了研究者的视线范围 。
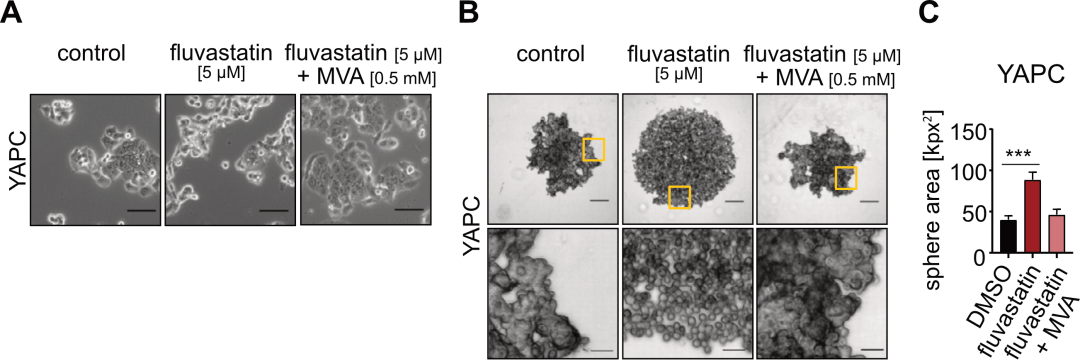
研究人员首先观察了他汀处理对体外培养人胰腺癌细胞(PDAC)形态特征的影响 , 发现 他汀能够诱导2D培养的细胞向间充质细胞形态转变 , 且使得3D培养的细胞形成球状的能力减弱、细胞间连接变松散 。
在分子机制上 , 他汀能够阻断3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)诱导酶HMGCR的合成 , 进而抑制HMG-CoA向甲羟戊酸(MVA)的转变[4] , 而无论向2D还是3D培养的细胞中添加MVA , 都可以使得细胞形态向上皮细胞转变或恢复球状生长能力 。
需要强调的是 ,他汀处理并没有抑制癌细胞的生长和增殖 , 说明细胞形态变化与该过程无关 。
文章图片
他汀处理PDAC细胞系使得细胞向间充质细胞形态转变 , 且细胞间连接变得松散 , 形成球状生长的能力变弱
为了明确他汀诱导癌细胞形态变化的分子机制 , 研究团队分析了胰腺癌细胞系ASPC1中相关蛋白及基因的变化情况 , 最终发现 三类通路中的蛋白表达水平在处理组与对照组中有显著差异 , 它们分别是胆固醇代谢通路、细胞凋亡信号通路和Rho GTP酶信号通路 。
他汀处理后的胆固醇代谢通路中 , HMGCR表达提高来帮助细胞合成新的胆固醇 , 但HMGCR下游的MVA对于这个通路显然更加重要 , 因为胞内胆固醇的二次合成主要依赖MVA的存在 。
细胞抗凋亡信号因子在他汀处理后被激活表达 , 以保证细胞能够继续存活而不至于凋亡失活 。
Rho GTP酶信号通路同样因为他汀处理而大量表达 , 这样细胞骨架和肌动蛋白束便能够重塑和组装 , 进而能够维持完整的细胞形态以保证癌细胞保持极性生长状态 , 以便其能够对抗他汀对癌细胞转移能力的抑制 。
- 卫生室|《乡村医生诊疗口袋书(先行本)》面世
- 按摩|你知道吗?间充质干细胞可以改善失眠症状
- 肝细胞|夏季来了,多吃以下3种食物,滋养皮肤,也可以淡化斑点
- 肝细胞|想长寿先养肝,多吃三种蔬菜,养肝护肝,滋补身体,脸色更红润
- 解读|《浙江省医院门诊管理办法》政策解读
- 廉东波|《健谈》观点丨浅表性胃炎三五年复查一次 萎缩性胃炎一年一查
- 家长|杭州《青少年皮肤健康状况调研》发布,近半青少年受皮肤疾病困扰
- 造血干细胞移植|保留脐带血,要还是不要?血液病专家告诉你答案,不用纠结了
- 肝细胞|肝不好的人,记住多喝3水,少吃1物,肝病会悄悄溜走
- 公报,监测,国民,体质|一图读懂《第五次国民体质监测公报》
