PD-1/PD-L1免疫检查点抑制剂虽然已经占据了肿瘤免疫治疗的半壁江山 , 但是它并不是能够一招制敌的灵丹妙药 。 现如今 , 我们虽然可以通过联合CTLA-4抑制剂来增强疗效 , 但是该联合疗法的3-4级不良反应率可以高达55%[1, 2] , 着实让人望而生畏 。
因此 , 开发安全有效的新型免疫检查点抑制剂及其联合疗法也就成为了当今研究的热点 。
近日 , 来自美国 Dana-Farber癌症研究所的Stephen Hodi教授 , 及来自澳大利亚黑色素瘤研究中心的Georgina Long教授 , 在《新英格兰医学杂志》上报道了新型免疫检查点 LAG-3抑制剂relatlimab联合PD-1抑制剂nivolumab的首个2/3期临床试验结果(RELATIVITY-047)[3] 。
研究发现 , 在不可切除或转移性黑色素瘤的一线治疗中 ,relatlimab+nivolumab联合疗法的无进展生存期(PFS)为nivolumab单药的两倍多(10.1 vs 4.63 月) , 有显著优势(HR, 0.75; P=0.006) , 且在各亚组中联合疗法的PFS优势依然突出 。 同时 , 患者对relatlimab+nivolumab联合疗法的耐受度较好 ,3/4级治疗相关不良反应发生率为18.9% , 且没有超出预期的新增不良反应事件 。
【方案|NEJM:新型免疫联合治疗临床3期首秀,大放异彩!】黑色素瘤的免疫联合疗法 , 无疑又迈出了一大步!

文章图片
▲ 论文首页截图
LAG-3是一种主要表达在活化的T细胞、B细胞、NK细胞和浆细胞样树突状细胞(pDC)上的新型免疫检查点 。
虽然现如今LAG-3调控肿瘤增殖的具体机制还不明晰 , 但比较明确的是 , LAG-3不仅可以和PD-1一样通过与MHCII类分子结合下调T细胞活性 , 它也可以通过增强调节性T细胞的抑制活性 , 来进一步降低效应T细胞的抗肿瘤活性 。
作为PD-1的“好兄弟” ,LAG-3可以在肿瘤浸润淋巴细胞表面和PD-1共表达 , 来协同促进T细胞的耗竭 , 这就为LAG-3抑制剂联合PD-1抑制剂提供了机制上的支持[4] 。
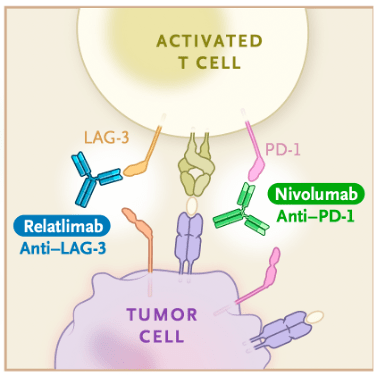
文章图片
▲ LAG-3抑制剂与PD-1抑制剂机制示意图
在这项 随机、双盲、全球多中心的2/3期临床试验中 , 研究人员一共纳入了714位不可切除或转移性黑色素瘤患者 。 患者需年满12周岁 , 且在入组前6个月内没有接受过PD-1、CTLA-4、BRAF或MEK抑制剂的辅助治疗、新辅助治疗或干扰素治疗 。
患者以1:1的比例被分层随机分配 , 分层因素为LAG-3表达(≥1% vs < 1%)、PD-L1表达(≥1% vs < 1%)、BRAF V600突变及AJCC转移分期(M0/M1+正常LDH vs M2+高LDH) 。 最终有355位患者接受了relatlimab+nivolumab联合治疗 , 359位患者接受nivolumab单药治疗 。
在给药方案上 , 两组均采用每四周一次的固定剂量单次静脉输注方案 , relatlimab及nivolumab的单次给药剂量分别为160mg及480mg 。 相较于现今用于黑色素瘤一线标准治疗的ipilimumab+nivolumab给药方案 , relatlimab+nivolumab这种混合制剂单次输注且固定给药剂量及频率的方案更为简洁便捷 , 可以避免不必要的给药失误 。
▲ RELATIVITY-047试验流程图
不过需要注意的是 , 此项试验中并 没有纳入葡萄球膜黑色素瘤患者 , 以及未经治疗的脑部或软脑膜转移患者 , 因此relatlimab+nivolumab联合疗法在此类患者中的疗效还需要后期的试验进一步研究 。
在入组的714位患者中 , 患者平均年龄63岁 , 8.4%的患者前期接受过术前或术后的辅助治疗 , 70.4%的患者为非肢端黑色素瘤 ,分别有75.2%、41%及38.5%的患者为LAG-3表达≥1%、PD-L1表达≥1%或携带BRAF V600突变 。
- 隔离|四川省新型冠状病毒肺炎疫情最新情况(1月23日发布)
- 冠状病毒肺炎|四川省新型冠状病毒肺炎疫情最新情况(1月21日发布)
- 治疗|“吃软饭”是治疗胃炎的最佳方案,这样下去,可以拥有好肠胃!
- 痛风|长期吃3种药可能会诱发痛风,如果你正在吃,建议调整方案
- 老人|重庆中医肿瘤专家石毓斌:选对中医方案,不花冤枉钱
- 治疗|运动神经元最新治疗方案
- 本文转自:燕赵晚报1月21日北京市举行新型冠状病毒肺炎疫情防控工作第271场新闻发布会北...|北京通报!累计报告23例丨石家庄市疾控中心发布最新提醒
- 疫情|四川省新型冠状病毒肺炎疫情最新情况(1月22日发布)
- 审评|一项创新型中医器械产品通过注册审评审批
- 方案|上班到底干啥?武汉健康管理师的日常工作
