众所周知 , 在所有癌症类型中 , 胰腺癌(PDAC)是“癌中之王” 。
80%的PDAC患者在确诊时已经存在了手术禁忌的转移癌 , 而余下的15-20%患者虽然可以手术治疗 , 但是也存在无法检测到的转移灶 , 这也导致了 70%左右的患者在手术后的24个月内出现远处复发转移 。 转移是所有肿瘤大夫都非常害怕的事情 , 基本上一旦患者被确诊为转移癌 , 他就已经进入了人生的倒计时 。
至今为止 , 对于胰腺癌患者 , 不管是原位进展的恶性肿瘤还是肿瘤的远处转移 , 化疗依旧是治疗的一线方案 。 同样 , 化疗也是原位肿瘤切除术后的主要辅助治疗手段 。
说起肿瘤转移的原因 , 大家首先想到的应该是EMT/MET (上皮间质化和间质上皮化) , 实际上早期肿瘤转移微环境的建立也非常重要 。 已经有研究证实髓系细胞能够通过多种机制参与胰腺癌的肝转移过程 , 包括建立促进肿瘤细胞种植的微环境 。 而 化疗后转移的机制一直都未明朗 。
近日 ,英国利物浦大学Michael C Schmid教授领导的团队 , 在BMJ旗下的子刊 GUT 发表了重要的研究成果[1] 。
【Schmid|GUT:“癌王”越化疗越“强”的原因竟是这样!】他们发现 , 在 化疗药物停止后 , 肿瘤细胞产生的CXCL1/2的趋化信号 , 会促使中性粒细胞向肝脏特异性浸润 。浸润的中性粒细胞会在肝脏中分泌大量的Gas6蛋白 , 转而激活肿瘤细胞表面的AXL受体 , 以此来促进肿瘤细胞在肝脏的生存和增殖 , 促进了胰腺癌向肝脏的转移过程 。
根据这一发现 , Schmid团队提出将Gas6/AXL信号通路的靶向药和常规化疗药物联用 , 来降低胰腺癌的复发与转移 , 延长患者的生存时间 。

文章图片
论文首页截图
接下来我们就一起来看看这个研究是如何开展的 。
首先 ,Schmid团队在小鼠体内建立了胰腺癌肝转移模型 , 然后在转移灶形成后(癌细胞种植的第12天)开始注射化疗药物吉西他滨 。
虽然在体外实验中肿瘤细胞对吉西他滨很敏感 , 而且体内实验也发现在化疗药治疗后转移灶负荷明显减轻(第22天) , 但是小鼠的生存率却没有提高 。
究其原因 ,原来转移瘤负荷在化疗药物停止后迅速回升 , 在差不多32-48天的时候 , 接受与未接受过化疗药物的转移瘤负荷居然没有差别了 , 这也 跟临床上的胰腺癌患者的情况很类似 。
可是 , 这又是为什么呢?
转移癌负荷在化疗刚结束明显下降 , 可是在停止化疗药物后短时间内 , 癌负荷迅速回升 , 最终导致化疗药物并不能延长胰腺癌负荷小鼠的生存期
因为化疗药物能够激活免疫反应[2] , 所以该团队分别在化疗期间以及停用化疗药物后检测了免疫细胞激活情况 。
非常有意思的是 ,化疗期间显示了激活的固有免疫和T细胞 , 而停药后这些现象都受到了抑制 , 说明了化疗药物只能够起到一个短期的作用 。 此外 ,在药物停用后 , 中性粒细胞和”巡逻”单核细胞在转移灶中显著增加 。
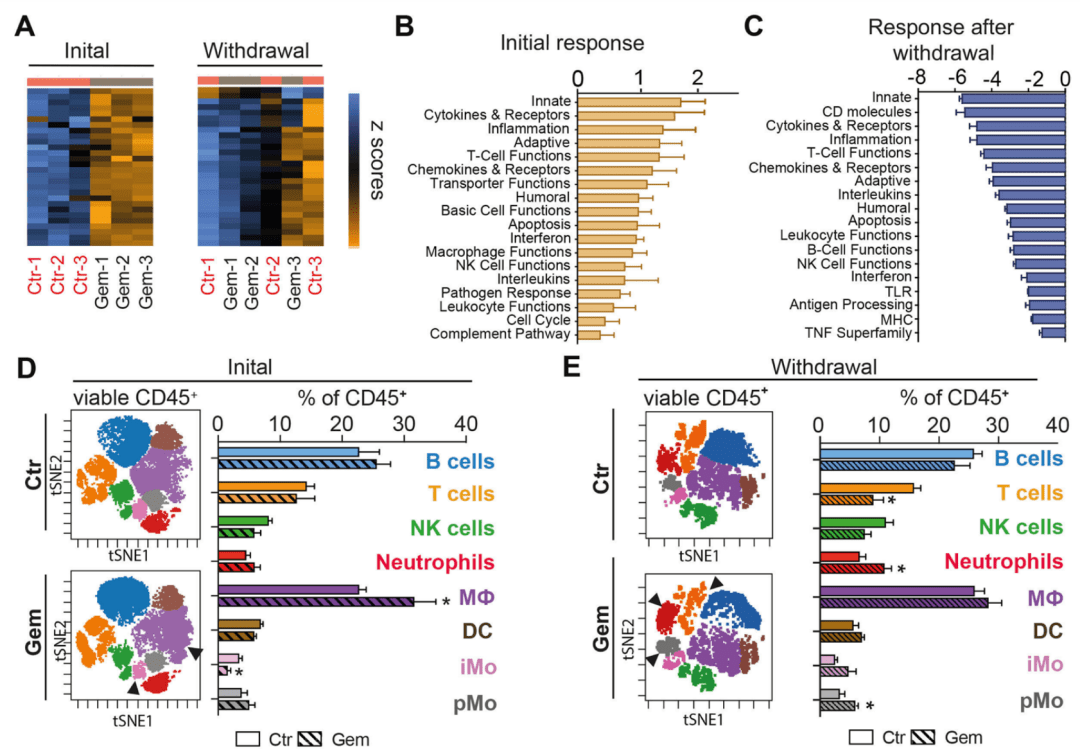
文章图片
固有免疫和T细胞在化疗过程中明显激活 , 在药物停用后 , 它们受到抑制 , 而中性粒细胞和巡逻单核细胞却明显增加
那么问题就来了 , 停止化疗后转移癌的快速增长和复发是不是由中性粒细胞和巨噬细胞导致的呢?
为了验证这个猜想 , 在用吉西他滨治疗的第二天 ,Schmid团队用两种单抗(aLy6G和aCSF-1)分别清除小鼠体内的中性粒细胞和巨噬细胞 。
- 张鸿祺|汇数万病例 集百医之长 这款人工智能成神外医生最强“工具包”
- 疾病|比乱吃药更厉害的是“自愈力”!人体最好的医生,可治好7成疾病 .
- 好处|常吃“豆腐乳”的人,到最后怎么样了?3个好处会“不请自来”!
- 气血充足|秋冬养气血,胜过吃补药!每天一碗,全身气血都“通”了
- 皮肤|藏在身边的“胶原蛋白”,女人常吃,或能紧致肌肤,不做黄脸婆
- 手术|打破高龄“禁区”|西安市第三医院神经外科成功“唤醒”百岁老人
- 磁共振|心脏性猝死可预防,这些高危人群可通过“心脏救护车”救命
- 橘子|肝不好的人,“养肝水果”可以多吃,补充维生素,或能修复肝功能
- 茯苓|湿气的“死对头”,不仅能够排毒养颜,还可以快速减肥瘦身
- 首选|8种降尿蛋白的“万能药”,谁是肾病的首选?
