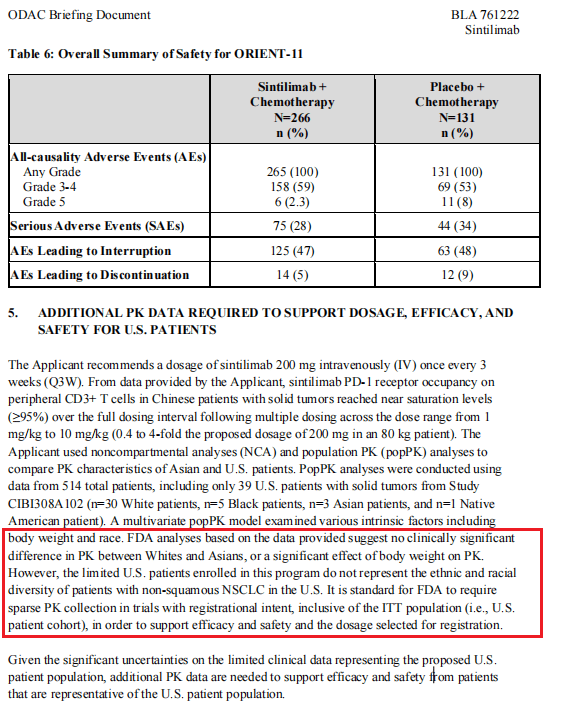
综合FDA文件等公开资料 , ODAC提出异议的主要原因是 , 信迪利单抗所基于的ORIENT-11三期临床仅在中国进行而非国际多中心临床研究(MRCT) , 不符合临床试验人群的多样性原则 。 此外 , 该临床试验以无进展生存期(PFS)为临床终点 , FDA则认为应当以总生存期(OS)为临床终点 , 且应该把已批准的PD-1疗法作为对照组进行头对头试验 。 该委员会建议 , 应在获批前补充额外临床试验 , 以证明信迪利单抗在美国人群和美国医疗实践中的适用性 。
文章图片
信迪利单抗需要更多的药物动力学数据 图源FDA网站
对于此事 , 信达生物制药集团总裁刘勇军表示:“ ORIENT-11是一项高质量、高标准、由经验丰富的临床研究者参与的符合全球认证GCP要求的中国临床试验 。 ORIENT-11试验结果数据展示了信迪利单抗的综合获益大于风险 。 FDA没有任何对于信迪利单抗安全性问题的质疑 。 虽然对于这次ODAC投票结果感到遗憾 , 我们将与礼来共同配合FDA继续完成BLA申请的相关审评工作 。 我们对信迪利单抗的质量与价值一如既往充满信心 。 ”
礼来制药肿瘤事业部总裁纳尔登(Jacob Van Naarden)则表示:“虽然我们对今天关于信迪利单抗的ODAC投票结果感到遗憾 , 我们依旧感谢有这个机会能公开充分地讨论信迪利单抗的注册申请 , 以及针对单一国家临床研究的监管尺度的广泛讨论 , 礼来和信达会一起配合FDA继续完成BLA的相关审评工作 。 ”
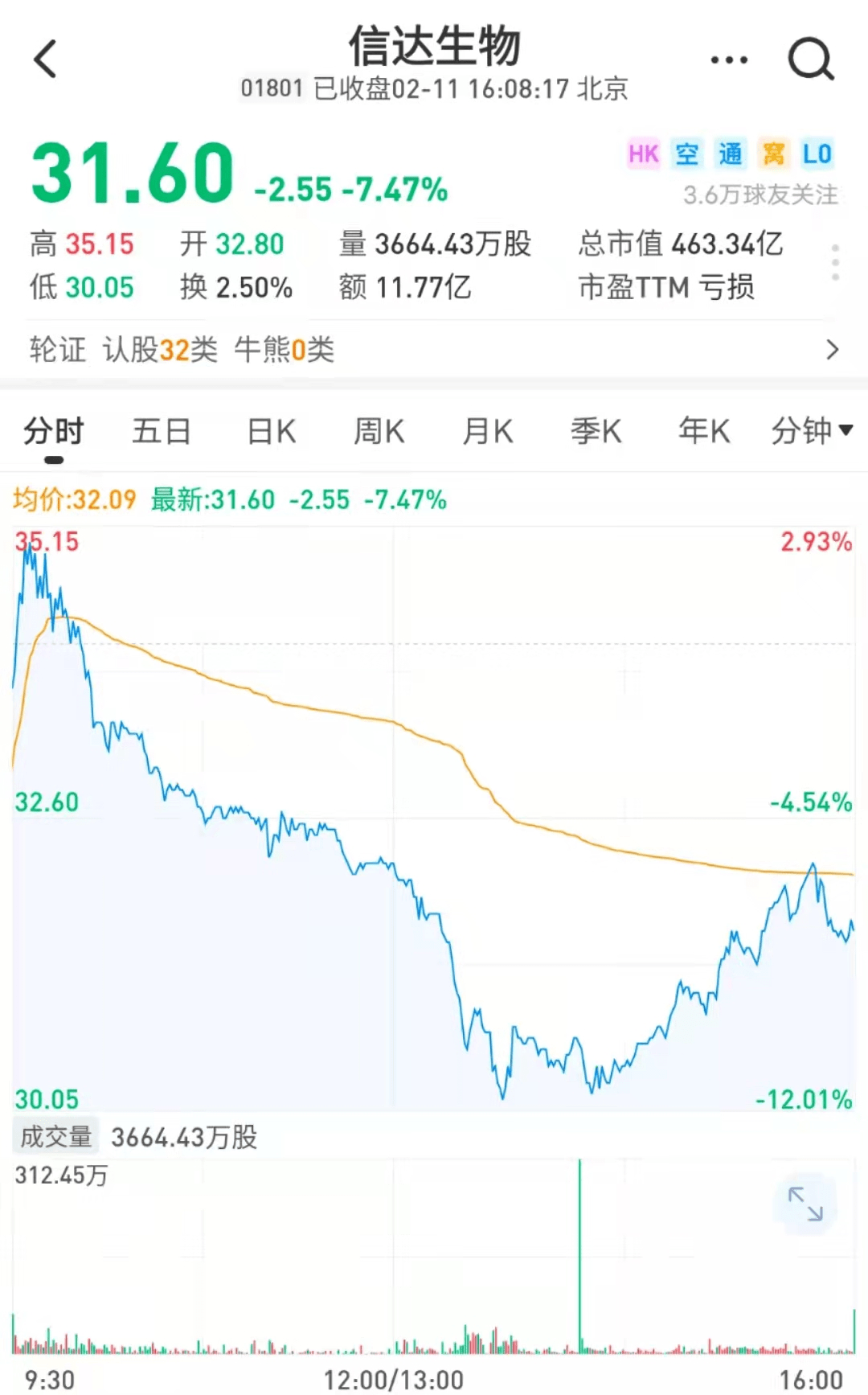
今日(2月11日)港股收盘 , 信达生物报每股31.6元 , 收跌7.47% 。 综合《每日经济新闻》报道 , 除信达生物外 , 君实生物、百济神州、恒瑞医药等国产PD-1企业也已向FDA递交上市申请 , 集体闯关FDA 。 国产PD-1出海之路值得进一步观察 。
文章图片
雪球网截图
- 汉娜·凯顿|花三年跨两国,看十几位医生 被诊断为“压力太大”的英国女子卵巢中取出排球大肿瘤
- 女子|花三年跨两国,看十几位医生 被诊断为“压力太大”的英国女子卵巢中取出排球大肿瘤
- 蕨菜|肿瘤主任癌症晚期,常吃3种蔬菜,或让你多活10年!
- 肿瘤|厦门大学附属第一医院:“厦”路相逢,共抗神经内分泌肿瘤
- 时代|狼疮肾炎迎靶向治疗时代,全球首款用于治疗狼疮肾炎的生物制剂在中国获批
- 技术|国家药品监督局发布《生物类似药临床药理学研究技术指导原则》
- 陈洪潭|27岁温州女子没吃两口饭就感觉饱,食管切出巨大肿瘤状似“麦克风”
- 豆腐皮|“长寿老人”的秘密被发现,我国产量大却没人吃,含钙量比牛奶高
- 上市|要求补充额外临床试验,国产PD-1首次闯关FDA遇挫
- 的结果|信达生物PD-1首闯FDA受挫,被要求补充临床试验
