
文章图片
2月10日晚间 , 国产PD-1肿瘤药——信达生物(01801)信迪利单抗直面美国食品和药物管理局(FDA)肿瘤药物咨询委员会(ODAC)会议审评 , 讨论其基于中国临床数据的有关联合疗法能否在美国获批上市 。
这是国产PD-1肿瘤药首次直面ODAC , 闯关FDA , 因此引发行业和投资者多方关注 。 最终ODAC要求信达生物补充额外的临床试验 , 信迪利单抗在美国上市申请暂时遇挫 。
11日信达生物发布公告称 , 该公司将和相关方继续与FDA配合 , 完成新药上市申请的审评工作 。 ODAC就已上市和临床中的肿瘤药品 , 为FDA提供独立的专业性意见 。 FDA在新药审批过程中将采纳ODAC的投票意见 , 但ODAC投票意见不具有对FDA决策的约束力 。

文章图片
公告截图
人体免疫细胞上有一个蛋白PD-1 (程序化死亡分子) , 而肿瘤细胞会产生一个免疫球蛋白样的分子PD-L1(细胞程式死亡-配体1) 。 两个分子结合时 , 会降低免疫细胞的活性 , 帮助肿瘤隐藏 。
PD-1/PD-L1抗体药可以阻断两者结合 , 从而让免疫细胞保持活性 , 杀伤肿瘤细胞 。 单抗即单克隆抗体 。 相比于化学药物 , 单抗药物通常不会错误识别和攻击正常细胞 , 具有用药量小、副作用小等特点 , 多用于肿瘤治疗 。
因此PD-1/PD-L1抗体药 , 常被看作“明星肿瘤药”、“抗癌神药” , 备受追捧 。 以PD-1默沙东K药为例 , 它2020年全球大卖143.8亿美元 , 到2021年第三季度保持了22%的增长 。 全球范围内获批的适应症近30种 , 甚至已有不限癌种适应症获批 。
另据弗若斯特沙利文早年分析 , 到2023年 , 全球PD-1/PD-L1市场规模可以达到600亿美元以上 , 中国市场也将接近千亿元水平 。 综合因素之下 , PD-1也一直被视为中国创新药发展的“风向标” 。 恒瑞医药、百济神州、君实生物和信达生物等企业 , 都在该赛道上有所布局 。
官网信息显示 , 信达生物成立于2011年 , 从事开发、生产和销售用于治疗肿瘤等重大疾病的创新药物 。 2018年10月31日 , 信达生物制药在香港联交所主板挂牌上市 。
信迪利单抗是信达生物制药(苏州)有限公司自主研发的创新生物药 , 由信达与礼来制药公司共同开发和商业化 。 信迪利单抗为全人源化的IgG4单克隆抗体 , 能特异性结合T细胞表面的PD-1分子 , 阻断这条免疫逃逸通路 , 重新激活T细胞 , 释放细胞因子杀伤肿瘤细胞 。
信达生物方面表示 , 信迪利单抗注射液的商品名为达伯舒 。 2021年12月 , 达伯舒成为唯一一个拥有包含一线非鳞状非小细胞肺癌、一线鳞状非小细胞肺癌、一线肝癌及霍奇金淋巴瘤在内的四项适应症获批 , 并均被纳入国家医保的PD-1抑制剂 。
【生物|国产肿瘤药首次闯关美国FDA暂时遇挫,信达生物回应】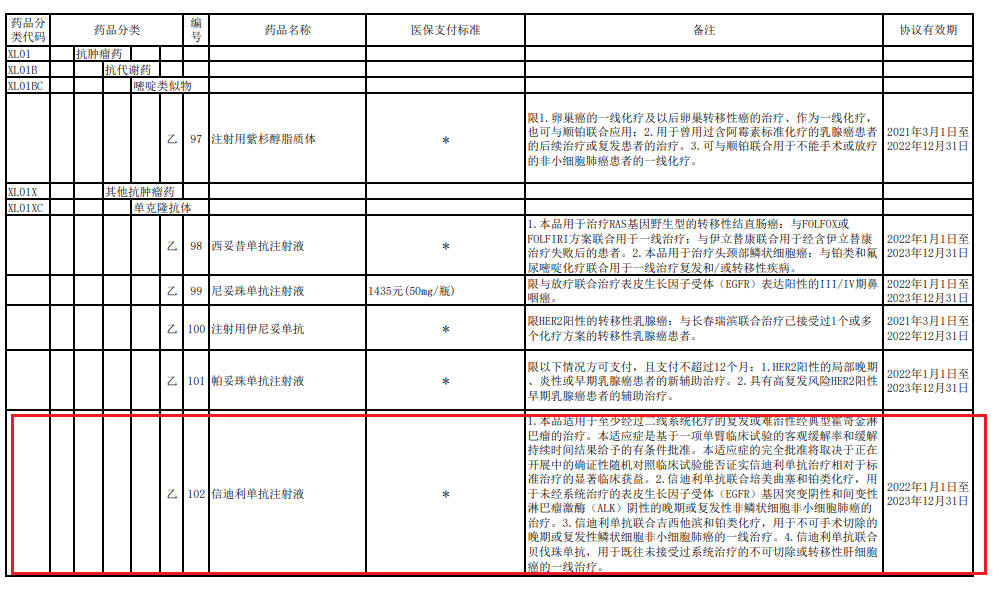
文章图片
《国家基本医疗保险、工伤保险和生育保险药品目录(2021年)》 协议期内谈判药品部分截图
信迪利单抗此番闯关FDA暂时受阻 , 或许与其三期临床试验有关 。
资料显示 , 引发中美双方关注的ORIENT-11研究是一项评估信迪利单抗注射液或安慰剂联合培美曲塞和铂类用于晚期或复发性非鳞状非小细胞肺癌一线治疗有效性和安全性的随机、双盲、III期对照临床研究 。
该研究共入组397例受试者 , 按照2:1随机入组 , 分别接受信迪利单抗注射液200mg或安慰剂联合培美曲塞和铂类治疗 , 每3周给药1次 , 完成4个周期治疗后 , 进入信迪利单抗或安慰剂联合培美曲塞维持阶段 , 治疗直至疾病进展、毒性不可耐受或其他需要终止治疗的情况 。 对照组疾病进展后可有条件交叉至信迪利单抗单药治疗 。
- 汉娜·凯顿|花三年跨两国,看十几位医生 被诊断为“压力太大”的英国女子卵巢中取出排球大肿瘤
- 女子|花三年跨两国,看十几位医生 被诊断为“压力太大”的英国女子卵巢中取出排球大肿瘤
- 蕨菜|肿瘤主任癌症晚期,常吃3种蔬菜,或让你多活10年!
- 肿瘤|厦门大学附属第一医院:“厦”路相逢,共抗神经内分泌肿瘤
- 时代|狼疮肾炎迎靶向治疗时代,全球首款用于治疗狼疮肾炎的生物制剂在中国获批
- 技术|国家药品监督局发布《生物类似药临床药理学研究技术指导原则》
- 陈洪潭|27岁温州女子没吃两口饭就感觉饱,食管切出巨大肿瘤状似“麦克风”
- 豆腐皮|“长寿老人”的秘密被发现,我国产量大却没人吃,含钙量比牛奶高
- 上市|要求补充额外临床试验,国产PD-1首次闯关FDA遇挫
- 的结果|信达生物PD-1首闯FDA受挫,被要求补充临床试验
