国产PD-1首次闯关FDA有了阶段性结果 。
美国东部时间2月10日 , 美国食品药品监督管理局(FDA)召开肿瘤药物咨询委员会(ODAC) , 对信达生物PD-1肿瘤药信迪利单抗注射液的新药上市申请(BLA)审评问题进行讨论并投票 , 以14比1的投票结果要求信达生物补充额外的临床试验 , 这也意味着国产PD-1闯关FDA遭遇挫折 。
【上市|要求补充额外临床试验,国产PD-1首次闯关FDA遇挫】这次国产PD-1首次直面ODAC , 冲击FDA , 因此备受外界关注 。 ODAC审查和评估有关用于治疗癌症的已上市和研究性人用药物产品的安全性和有效性的数据 , 并向监管部门提供适当的建议 。 其建议虽然没有法律效力 , 但监管部门的最终批准往往与该机构的建议一致 。 目前 , FDA最终审议尚未公布 。
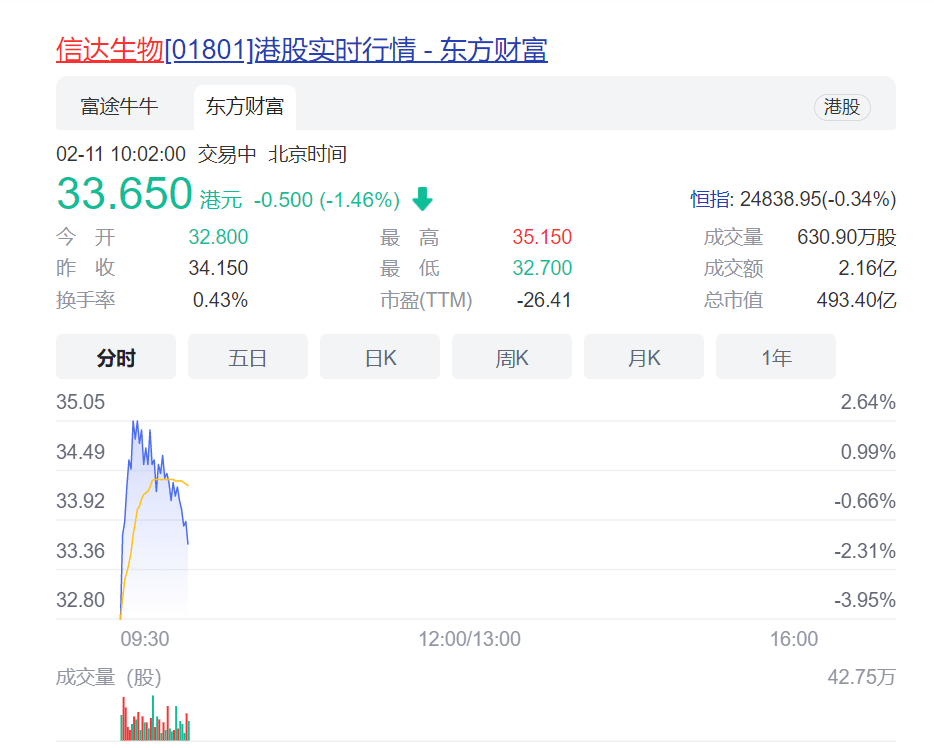
虽然结果不理想 , 但作为首个闯关FDA的企业 , 信达生物被行业视为中国创新药出海的“探路者” 。 从二级市场来看 , 信达生物(01801)港股低开4% , 不过随后回涨 , 一度涨超2% 。 截至发稿 , 信达生物下跌近1.5% 。
文章图片
信迪利单抗为什么没有获得ODAC推荐?
ODAC会议是在美国东部时间2月10日上午10时至下午3时(即北京时间2月10日晚间11时至2月11日凌晨4时)进行 , 委员会专家讨论的焦点与会前外界的担忧基本一致 , 这也是业内对这一结果并不意外的重要原因 。

文章图片
ODAC会前就信迪利单抗公布素材列出的讨论主题
委员会认为 , 信迪利单抗提交上市申请所基于的ORIENT-11三期临床仅在中国进行而非国际多中心临床研究 , 不符合临床试验人群的多样性原则 , 其结果不适用于美国患者 。 另外 , ORIENT-11试验的临床终点是无进展生存期(PFS) , 而非总生存期(OS) 。
值得一提的是 , 有委员会专家提出建议 , 信迪利单抗应该与在美国已经获得批准的PD-1疗法进行头对头试验 。
“头对头试验”是将临床上已经使用的治疗药物或治疗方法作为对照进行的临床试验 , 可看作是两种药物在有效性和安全性上的直接单挑 。 这不仅需要药物本身疗效和安全性过硬 , 耗时且花费大 , 对企业来说是巨大的挑战 。
以PD-1为例 , 已经有多款药获批 , 包括默沙东的帕博利珠单抗(K药)和百时美施贵宝的纳务利尤单抗(O药) 。 根据默沙东和百时美施贵宝最新公布的财报 , 2021年K药营收172亿美元 , O药销售收入75.23亿美元 。
如果开展头对头试验 , 则意味着信迪利单抗或将直面这两款经典PD-1药物 。
信达生物:一如既往充满信心
虽然信迪利单抗是国产PD-1 , 但很早之前 , 信达生物就与跨国药企礼来签署了合作 。 2020年8月 , 双方宣布将扩大战略合作 , 信达生物将授予礼来信迪利单抗在中国以外地区的独家许可 。

文章图片
礼来声明
对于此次ODAC结果 , 礼来当地时间2月10日在全球官网发布消息称感到失望 , 但很高兴有机会公开讨论与单一国家临床试验相关的应用和更广泛的问题 。
北京时间2月11日早间 , 信达生物就ODAC评审发布公告 , 强调ORIENT-11是一项高质量、高标准、由经验丰富的临床研究者参与的符合全球认证GCP要求的中国临床试验 。 FDA没有任何对于信迪利单抗安全性和有效性问题的质疑 。 公司与合作伙伴礼来将继续与FDA配合完成新药上市申请的审评工作 。
- 的结果|信达生物PD-1首闯FDA受挫,被要求补充临床试验
- 健康|5种食物可助孩子健康成长
- 换季养生,多吃3种食物,补充营养、改善体质,有益身体健康
- 最新!中高风险地区入(返)鼎人员健康管理要求一览表(2月10日)
- 养生|50岁大姐高血压15年,坚持补充叶酸半年,情况如何?听听医生怎么说
- 食材|家里再穷,也要给孩子吃一次它,能补充氨基酸,个头猛长不发胖!
- 补充|新研究:人体缺维D,患新冠重症可能性增加14倍
- 营养|女性到了中年常吃3种食物,补充营养、增强体质,好吃又健康
- 皮肤|女性想要皮肤好,每天吃些,补充营养,排毒润肠,增强体质
- 哈密瓜补充身体所需的营养成分
