近年来 , 免疫治疗凭借其远超传统疗法的效果 , 以及较少的副作用 , 彻底改变了癌症临床治疗的现状 。 但是副作用少并不代表没有 , 大约有10%-60%的黑色素瘤患者 , 在接受免疫治疗后会出现严重的免疫相关副作用(irAEs)[1] 。
这些副作用会对患者的许多器官组织造成破环性影响 , 导致多种疾病甚至死亡 , 然而 引起irAEs的生物学驱动因素仍然不明确 , 并且在临床实践中也缺乏判断患者出现irAEs风险的标准方法[2] 。
近日 , 由 华盛顿大学的Aadel A. Chaudhuri和斯坦福大学的Aaron M. Newman领衔的研究团队 , 在《自然·医学》发表重要研究成果[3] 。
他们利用多种测序和流式细胞技术 (主要是单细胞测序、bulk测序 , 以及TCR测序) , 分析了96个免疫治疗前和治疗早期的黑色素瘤患者血液样本和3个患者队列 (分别包括27、26、28例患者) , 发现 在治疗前血液中活性CD4记忆T细胞丰度 , 以及TCR的异质性与患者出现irAE有关 , 并且这一关联与发生副作用的器官无关 。

文章图片
▲ 论文首页截图
免疫治疗的原理就是通过给免疫系统“松绑”——利用免疫检查点抑制剂阻断免疫抑制通路 , 来激活免疫细胞(主要是T细胞) , 从而使其攻击癌细胞产生抗癌效果 。
但是这样的方式同样增加了正常组织被免疫系统攻击的风险 , 会造成免疫相关的不良反应 , 而由于受到免疫系统攻击的器官组织不同 , 免疫治疗产生的不良反应也并不一致 。 通常受影响的组织包括肺、肝、心脏、皮肤、垂体以及胃肠道[4] 。
之前有一些研究探究了与irAE有关的生物标志物 , 但是 要么只专注于对免疫治疗早期出现irAE进行预测 , 或者是预测单个器官的irAE , 要么就是没有将出现低分级irAE的患者纳入分析[5-7] 。
这些结果都 没有证明是否存在一个通用的治疗前就能检测 , 且与治疗后irAE有关的免疫状态 。
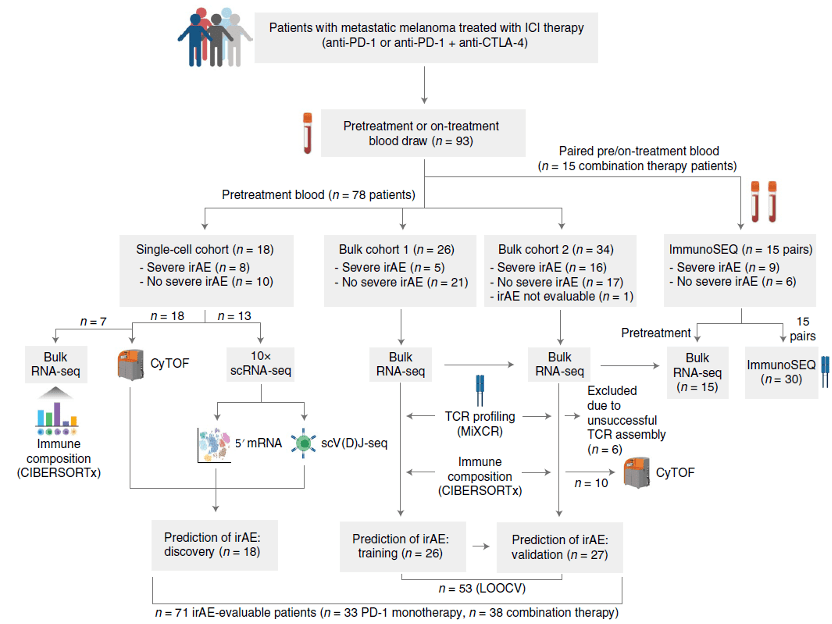
为了解决这个问题 , Aadel和Aaron团队招募了78例转移性黑色素瘤患者 , 在采用排除标准后 , 最终纳入分析的为71例患者 。 其中33例患者接受PD-1抑制剂治疗 , 38例患者接受PD-1和CTLA-4抑制剂联合治疗 。
他们随后将这71例患者分为3个不重叠的队列:1个应用单细胞技术的队列 , 两个应用bulk测序技术的队列 (其中一个为模型训练队列另一个为验证队列) 。
文章图片
▲ 研究设计
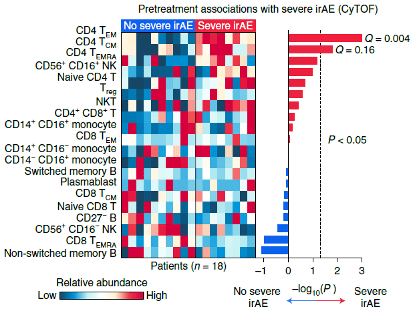
研究人员分别分析了每个亚群与出现严重irAE之间的关联 , 发现 在治疗前只有CD4效应记忆T细胞(Tem)的丰度与irAE有关 。
文章图片
▲ 在患者治疗前血液中 , 治疗后出现irAE的患者CD4Tem丰度要显著高于不出现irAE的患者
为了进一步证实这个结论 , 他们对18例患者中的13例患者的治疗前血液样本进行了单细胞TCR和BCR测序 , 然后基于一些经典的特征基因的表达量 , 将24807个细胞分为了32种具有不同转录组状态 (特征基因组合表达水平的差异)的细胞亚型 。
接着研究人员计算了32种细胞亚型的丰度与出现irAEs的关系 , 发现 CD4T细胞状态5(state 5)与出现严重的irAEs有关 。 而CD4T-state5在特征基因表达模式上与CD4Tem一致 , 并且在流式细胞分析中 , CD4T-state5的丰度与CD4Tem是有关联的 。
后续分析中他们发现 CD4T-state3也与irAE有关 , 并且将其与CD4T-state5组合成一类后 , 这个组合与irAE的关系更强了 。 然后他们将CD4T-state5和state3的组合根据与激活状态有关的标志物分成了活性和休眠两个亚群 , 发现和休眠亚群相比 , 活性亚群与irAE的关系更强 , 表明活性CD4Tem更有可能导致严重的irAEs 。
- 限制|《科学》:饭吃八分饱,免疫不怕老!重新解读迄今最大队列研究,发现长期热量摄入减少14%可逆转胸腺衰老,并找到新抗衰关键因子
- 机器人|二十多岁患上“老年病”!关节疼痛,可能与穿短裙、高跟鞋有关
- 不清楚各位是否有看了一部走红的韩国电视剧《梨泰院》|海鲜豆腐汤怎么做好喝?多喝这道汤可以提升身体免疫力
- 脖子后长“富贵包”的人越来越多,和什么原因有关?怎么消除它?
- 陈皮|《医方集解》的一个经典药方,6味中药,健脾消食,恢复脾胃功能
- 粮食作物|刘先银经典点说《黄帝内经》经常失眠的人,为什么将“五谷为养”放在第一位?
- 营养素|为什么更年期女性容易失眠?或与缺乏1种营养素有关,不妨多补充
- 恶性肿瘤|【疑问医答】胰腺炎与胰腺癌有没有关系?
- 法治|卫生健康法治宣传之《传染病防治法》
- 控制|有关糖尿病饮食的4大误区,“糖友”须知,尤其是第一个!
