抗PD-1/PD-L1免疫治疗可以说是万众瞩目 , 且临床试验证明其具有持久的抗肿瘤效应 , 并改变了包括非小细胞肺癌(NSCLC)在内的多种晚期癌症的治疗[1] 。 然而 , 只有不到20%的NSCLC患者可以从抗PD-1/PD-L1免疫治疗中获益 , 而这些患者中又有20%-40%遭受严重不良反应[2] 。
近日 , 由 上海复旦大学陈海泉教授和李飞教授 , 以及纽约大学格罗斯曼医学院Kwok-Kin?Wong共同领衔的研究团队 , 在 Science Advances 期刊上发表重要研究成果[3] 。
他们发现 ,TSC1/TSC2(结节性硬化症综合征亚单位1/2)突变的NSCLC患者 , 相比于未突变患者 , 接受ICB治疗后临床受益持久和生存率增加 , 表明TSC1/TSC2缺失使NSCLC患者对ICB疗法变得敏感 。

文章图片
▲ 论文首页截图
目前 , 虽然PD-L1的表达是FDA唯一批准用来预测NSCLC ICB治疗的生物标志物 , 但是ICB治疗不仅能显著提高PD-L1强阳性患者的生存率 , 也使部分PD-L1阴性患者的生存率得到一定提高 , 表明 PD-L1的表达作为生物标志物存在一定缺陷[2] 。
此外 , 一些特定致癌基因和抑癌基因的体细胞突变 , 包括EGFR、KRAS和P53 , 也已被证实与ICB治疗反应有关 。 事实上 , 肿瘤细胞的遗传变异可以通过多种机制调节宿主的抗肿瘤免疫应答 , 如调节PD-L1的表达和改变肿瘤微环境(TME)[4] 。
研究人员为了寻找新的免疫调节剂 , 他们在 Kras G12D /Trp53 -/- (KP)肺癌小鼠模型中进行了体外和体内CRISPR筛选 , 发现 TSC1和TSC2是 PD-L1表达的有效调节因子 , 可以促进PD-L1的表达 , 且对PD-1抑制剂治疗敏感。 因此 , 后续研究将研究目标锁定在TSC1和TSC2上 。
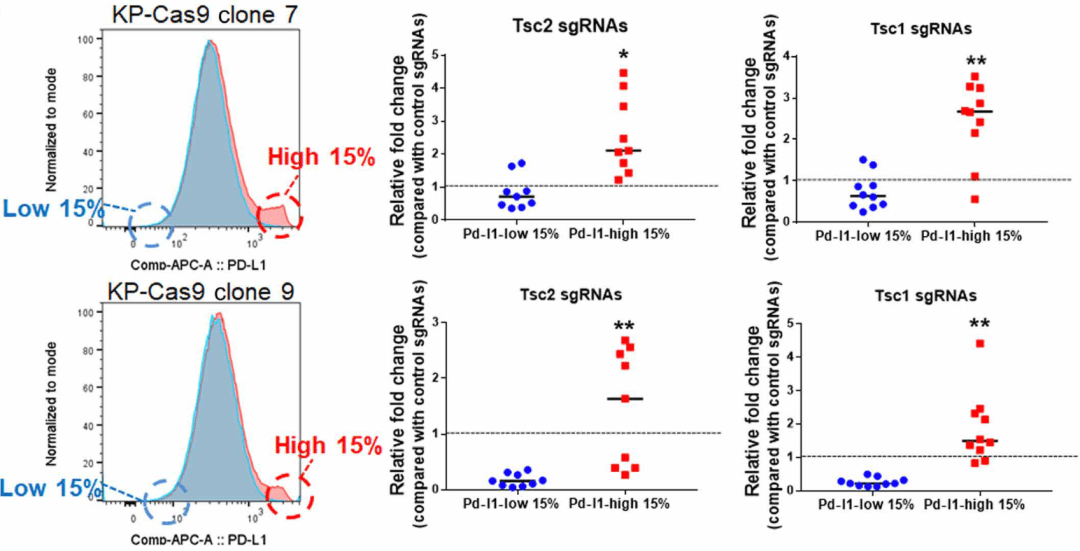
文章图片
▲ 体外筛选中两个克隆Tsc1和Tsc2的sgRNAs均富集在PD-L1高细胞群中
小伙伴们不禁会问 , TSC1和TSC2具有什么作用呢?
已有研究表明 , TSC1/TSC2可以介导磷脂酰肌醇3-激酶-AKT和肝激酶B1-腺苷5′-单磷酸-活化蛋白激酶通路之间的相互作用 ,通过Rheb抑制mTORC1信号通路 , 起到肿瘤抑制作用[5] 。
另外 , TSC1/TSC2突变失活可导致结节性硬化症(一种常染色体显性疾病) , 它也经常发生在包括NSCLC在内的许多人类癌症中[6] 。
研究人员为了全面研究TSC1/TSC2的状态与NSCLC免疫特征之间的临床相关性 , 以及ICB治疗TSC1/TSC2缺陷型NSCLC的疗效 , 他们先后在肺癌细胞系、患者样本、癌症基因组图谱(TCGA)数据库和同基因小鼠模型中分别进行了分析研究 。
首先 , 为了证实体外CRISPR的筛查结果 , 研究人员利用肺癌细胞系转染 TSC1或TSC2的单个sgRNAs , 以及建立 Tsc2 -敲除(KO)KP细胞系和A549细胞系 , 均证实 TSC2的缺失可以显著增加细胞膜PD-L1的水平 。
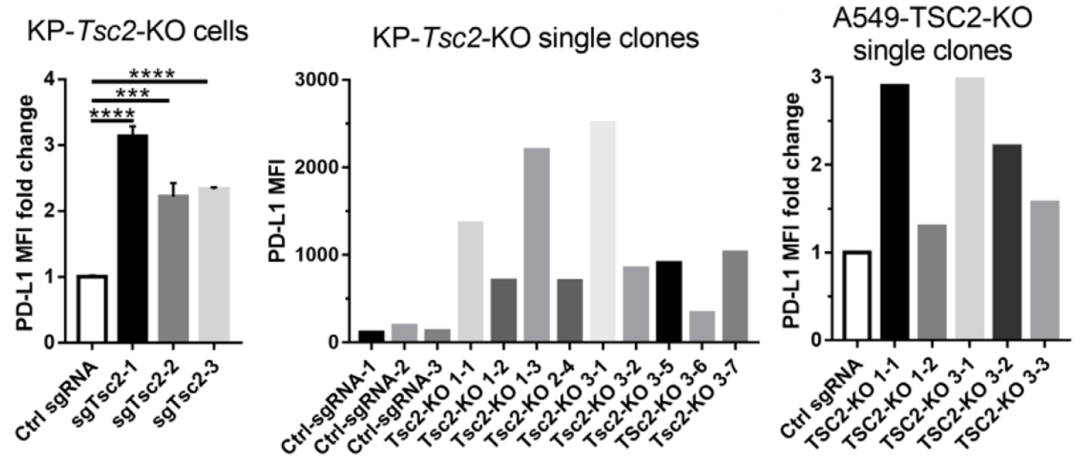
文章图片
体外验证Tsc2的缺失可以显著增加细胞膜PD-L1的水平
研究人员通过转染人TSC2编码序列补救KP- Tsc2 -KO细胞系 , 发现TSC2的再表达 , 可以明显抑制 PD-L1的表达水平;qRT-PCR分析进一步表明 TSC2可以在转录水平上调控 PD-L1的表达。
紧接着 , 研究人员利用复旦大学附属肿瘤医院NGS队列中接受手术切除的865例NSCLC患者的数据 , 进一步分析了TSC1/TSC2突变状态与PD-L1表达水平之间的相关性 。 结果显示: 与TSC1/TSC2野生型肿瘤相比 , TSC1/TSC2突变型肿瘤的PD-L1阳性率更高 , 与之相一致的是TSC1/TSC2扩增肿瘤中PD-L1阳性率最低 。
此外 , 由164例手术完全切除的NSCLC患者组成的组织芯片(TMA) , 经免疫染色后同样发现 ,TSC2低表达患者的PD-L1表达水平高于TSC2高表达患者 , 进一步证实TSC2突变缺失与PD-L1的上调相关 。
- 首胜|《自然·医学》:益生菌+免疫治疗,抗癌首胜!全球首个益生菌联合免疫治疗1期临床结果公布,患者中位PFS提升超400%丨临床大发现
- 阳性|抗肿瘤新药T-DXd落地博鳌乐城 用于乳腺癌和胃癌
- 教育|喜报|医院《为民族大爱助“一臂之力”》获自治区“铸牢中华民族共同体意识 讲好身边的民族团结故事”评选一等奖
- 发展中心|【妇产荣誉】北京妇产医院作品《疫情下的助产士》获得第六届健康中国微视频大赛优秀创意作品奖
- 花生如何吃的科学 吃的营养
- 声音|【全国爱耳日】用心聆听,科学用耳!
- 成都普济中医肿瘤医院:春季食疗养生中常见的四种菜,你都看见过
- 治疗|《人世间》主角之一因急性肾衰自杀,其实急性肾衰≠尿毒症,能治愈!
- 速递|文献速递|YAG 激光玻璃体消融术治疗有症状飞蚊症的有效性和安全性
- 本文转自:上游新闻为落实《“健康中国2030”规划纲要》要求|大足区人民医院:彰显专科护理,实施人文关怀
