蛋白|癌细胞竟学会“下毒”了!科学家首次发现黑色素瘤细胞分泌阿尔茨海默病“毒蛋白”,让星形胶质细胞促癌转移,并抑制小胶质细胞的吞噬功能( 二 )
文章图片
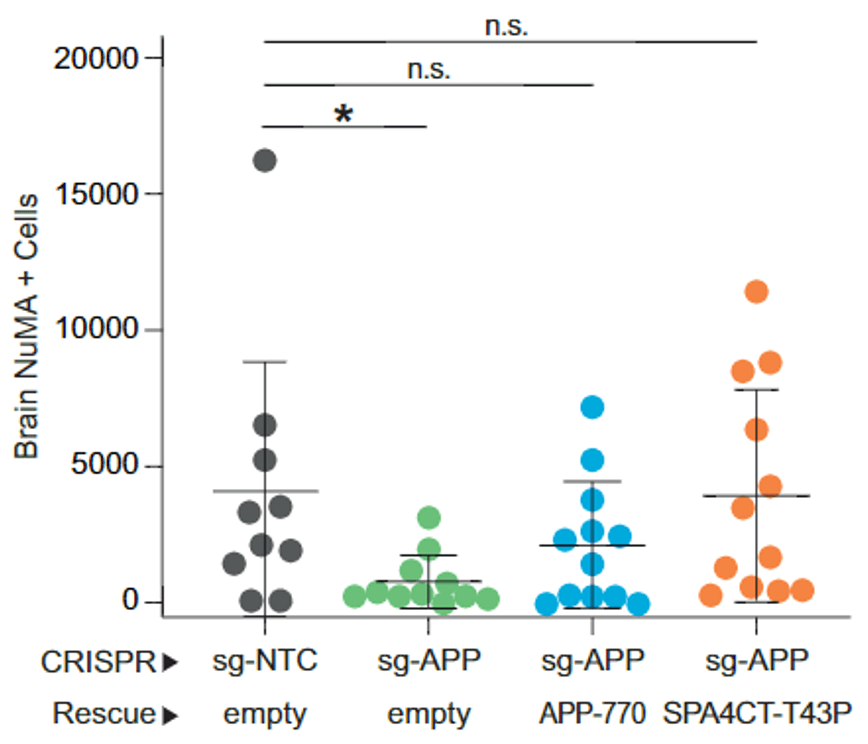
▲ 回补实验证明Aβ是APP发挥促肿瘤脑转移的形式
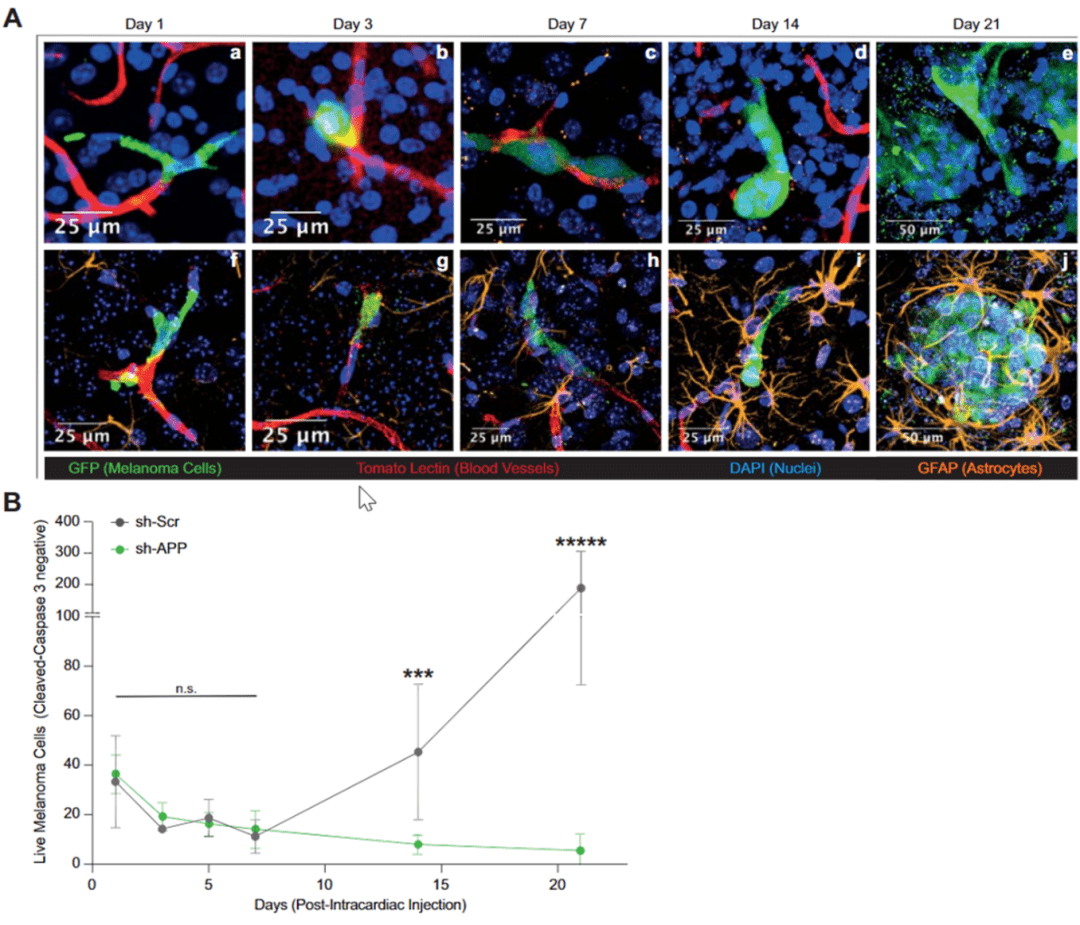
那么Aβ在黑色素瘤脑转移中究竟发挥怎样的作用呢?Hernando团队首先观察了黑色素瘤细胞转移入大脑的过程 , 建立了转移的时间线 。 随后比较了敲低APP的黑色素瘤细胞与野生型(WT)黑色素瘤细胞转移过程的区别 。
实验结果显示 ,敲低APP对肿瘤细胞在脑血管停滞、外渗以及在血管中生长并没有影响 , 但是缺乏APP的肿瘤细胞无法在脑实质中建立转移灶 , 而是发生了凋亡 。 这些数据表明黑色素瘤细胞需要Aβ帮助其在脑实质定植 。
文章图片
▲ A:黑色素瘤脑转移时间线;B:敲低APP的肿瘤无法建立转移灶
为何Aβ具有帮助黑色素瘤细胞在大脑定植的能力呢?已有的研究显示星形胶质细胞是肿瘤脑转移的重要调控者 , 而 Aβ对星形胶质细胞功能具有显著的影响[9-11] 。 因此Hernando团队假设Aβ是通过影响星形胶质细胞的功能来促进肿瘤细胞定植的 。
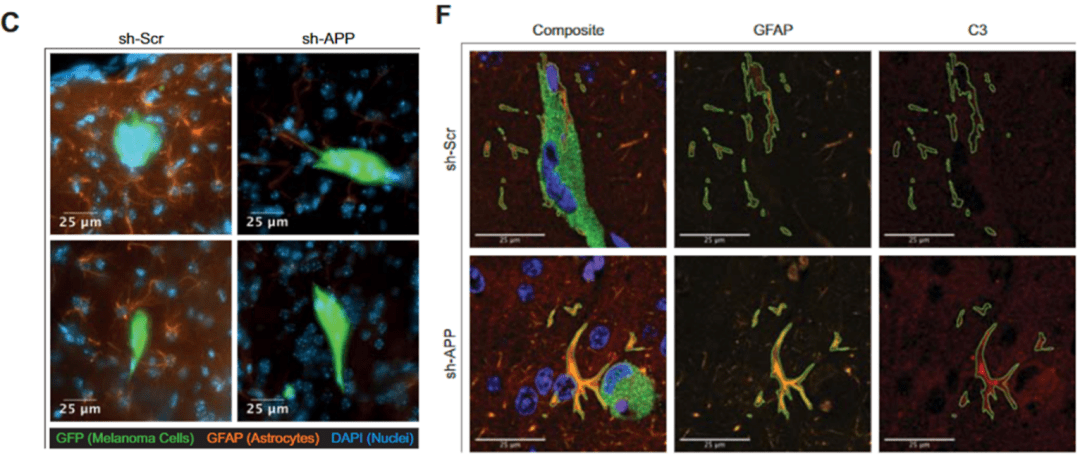
他们从免疫荧光结果中发现 , 缺少APP的肿瘤细胞周围星形胶质细胞显著减少 。 这说明 肿瘤细胞分泌的Aβ可以促进肿瘤局部星形胶质细胞增加 。
那Aβ对星形胶质细胞的功能有何影响呢?Hernando团队使用黑色素瘤细胞条件培养基培养原代星形胶质细胞 , 发现 Aβ抑制了星形胶质细胞的多种炎症信号通路 , 尤其是补体级联反应通路 。
通过免疫荧光技术、共聚焦显微镜以及三维成像技术 , Hernando团队验证了测序的结果 , 并且发现在炎症型星形胶质细胞(A1)中高表达的补体C3蛋白在Aβ存在的情况下减少了 。 这些数据表明 Aβ抑制了星形胶质细胞的炎症性A1极化 , 促进肿瘤的免疫逃逸 。
文章图片
▲ C:敲低APP后脑转移肿瘤细胞周围形形胶质细胞数量显著减少;F:在Aβ存在的情况下星形胶质细胞的C3表达显著下降
考虑到星形胶质细胞分泌的C3可以刺激小胶质细胞向促炎表型极化并增强其吞噬功能[12-14] , 因此Hernando团队假设Aβ可以抑制小胶质细胞向促炎表型极化以及吞噬功能 。
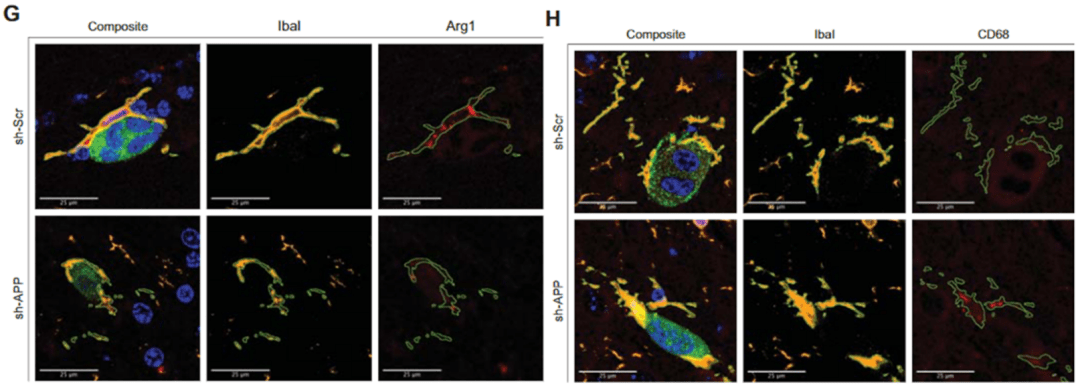
他们通过免疫荧光技术、共聚焦显微镜以及三维成像技术 , 观察黑色素瘤相关小胶质细胞(Iba1 + )的表型 , 发现 在有Aβ的情况下 , 小胶质细胞表达更多的抗炎介质Arg-1 , 而吞噬功能标志物CD68的表达则显著下降 。
这些数据表明 , Aβ可以促进小胶质细胞的抗炎表型极化 , 并且保护黑色素瘤细胞免于小胶质细胞的吞噬 。
文章图片
▲ 在Aβ存在的情况下小胶质细胞高表达抗炎介质Arg-1 , 吞噬功能下降
既然我们已知Aβ在黑色素瘤脑转移中的重要作用 , 那么抑制Aβ可以减少黑色素瘤的脑转移吗?
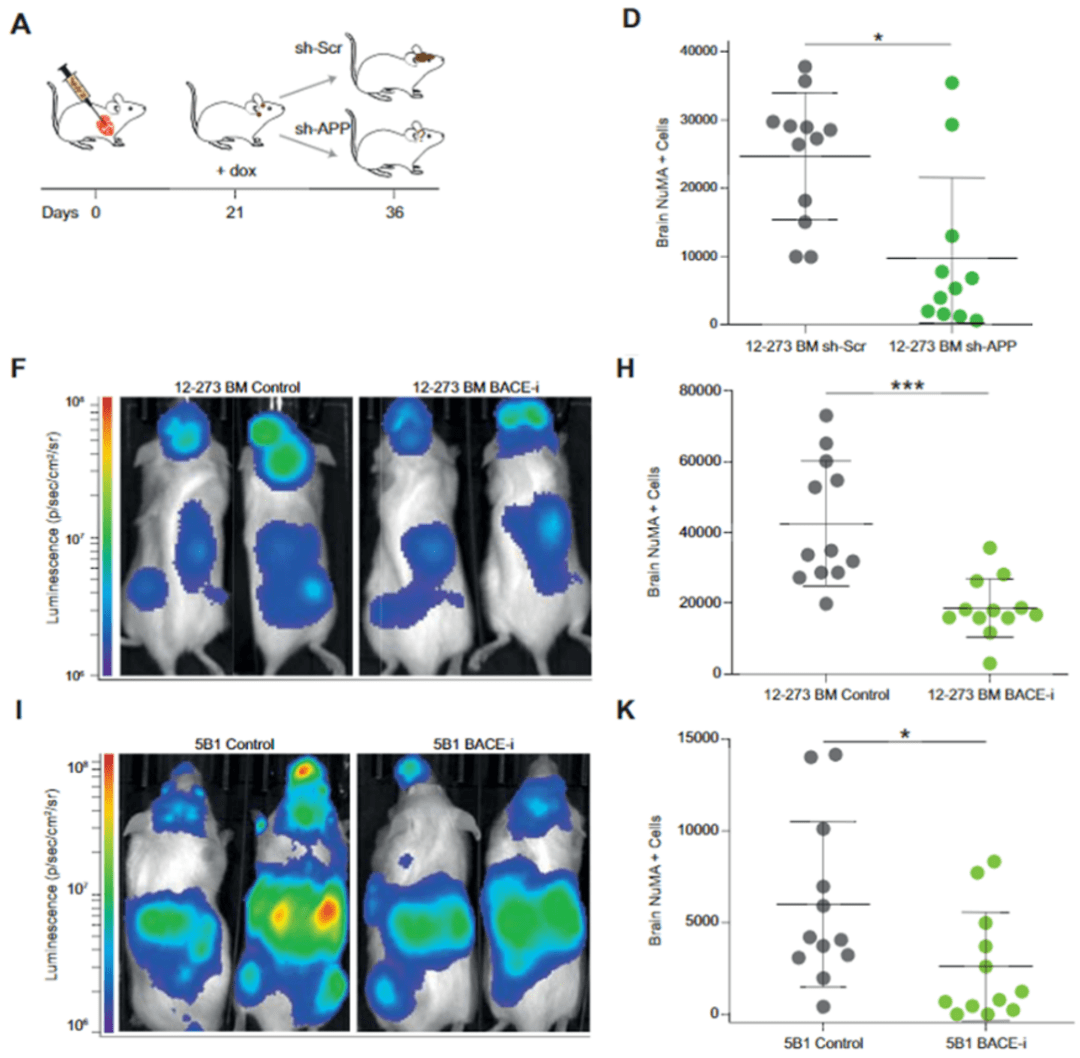
Hernando团队通过诱导性shRNA系统在已经建立的脑转移模型中敲低APP的表达 , 实验结果显示 ,即使在已经建立的脑转移瘤中 , 敲低APP也能够显著降低肿瘤负荷 。
随后 , Hernando团队使用了一种 β分泌酶抑制剂(BACEi)治疗荷瘤小鼠 , 可以看到 抑制Aβ分泌后脑转移瘤显著减少 。 这些结果提示 , 抑制Aβ可以有效减少黑色素瘤脑转移并抑制肿瘤生长 。
文章图片
- 综合征|【首儿医典】直立性蛋白尿
- 肾脏|【首儿医典】直立性蛋白尿
- 103岁老人,40年竟没进过医院 没吃一片药,只因做了一件事!
- 视网膜|合肥普瑞眼科科普|糖尿病竟然会引发这些眼病?你一定要知道
- 儿童染幽门螺杆菌,竟然影响发育?
- 女子|厦门30岁女子肺部长肿瘤,竟是一颗痣惹的祸?医生:要警惕
- 蛋白尿|【世界肾脏日】吾爱吾肾 知识强肾
- 肾脏|如何迅速降蛋白?医生道出2点“秘诀”,但不少人没意识到
- 【生活小贴士】惊!这样剪指甲竟会导致
- 癌细胞|44岁患癌,100岁仍健在,3个习惯或让秦怡战胜癌细胞,分享给你
