转移是肿瘤患者死亡的主要原因之一[1] 。 不同的肿瘤转移偏好并不相同 ,40-75%的IV期黑色素瘤患者会发生脑转移[2,3] 。
尽管已有临床试验结果表明 , 黑色素瘤脑转移灶对已经获批的靶向疗法以及免疫治疗仍有响应 , 但是这种应答持续时间较短 , 大多数患者最终死于脑转移瘤 [4-7] 。 因此 , 我们迫切需要了解黑色素瘤脑转移机制 , 并为脑转移的患者提供新的治疗策略 。
近日 , 由 纽约大学朗格尼医学中心的Eva Hernando教授领衔的研究团队在 Canecr Discovery 期刊发表研究成果 [8] 。
他们发现 进入大脑的黑色素瘤细胞为了生存 , 竟然会分泌β-淀粉样蛋白(Aβ) , 这些Aβ蛋白会招募并促进星形胶质细胞向促癌表型转化 , 同时还能阻止小胶质细胞吞噬黑色素瘤细胞 。
让导致阿尔茨海默病的“头号嫌疑犯”为自己的转移服务 , 黑色素瘤这招真是绝了!
不过 , 黑色素瘤细胞可能没想到 , 已经用于临床研究的Aβ抑制剂就在前面等它呢! Hernando团队发现抑制Aβ蛋白分泌的BACE抑制剂可以减少黑色素瘤的脑转移 。
这就是“魔高一尺道高一丈” 。

文章图片
▲ 论文首页截图
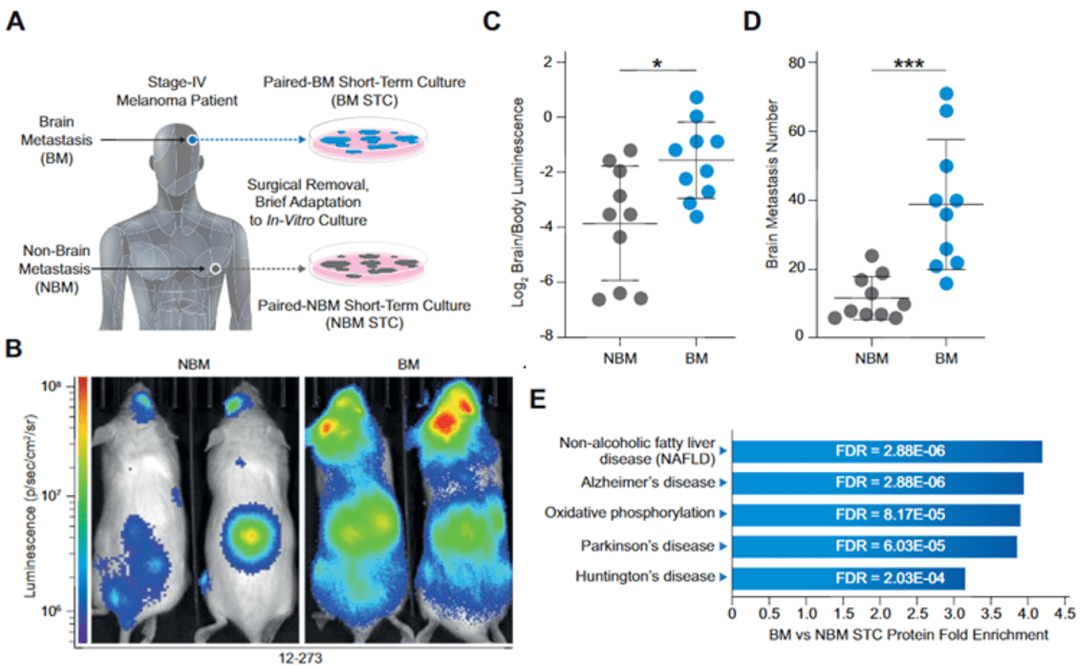
为了寻找脑转移灶肿瘤的特征 , Hernando团队将同一个黑色素瘤患者的脑转移灶(BM)和非脑转移灶(NBM)中的肿瘤细胞分离出来 , 短期培养后使用短期培养物(STC)进行小鼠荷瘤实验 , 以及无偏差蛋白质组分析 。 小鼠荷瘤实验显示 ,脑转移灶来源的肿瘤细胞表现出更强的脑转移能力 。 这表明脑转移灶的细胞具有独特的能力 , 能够更好的适应大脑内的环境 。
蛋白质组分析显示 ,脑转移灶肿瘤细胞富集与神经退行性疾病(阿尔茨海默病、帕金森病和亨廷顿病)的蛋白质 。
文章图片
▲ A:标本获取示意图;B-D:BM-SCT具有更强的脑转移能力;E:BM-SCT上调多种与神经退行性疾病相关通路
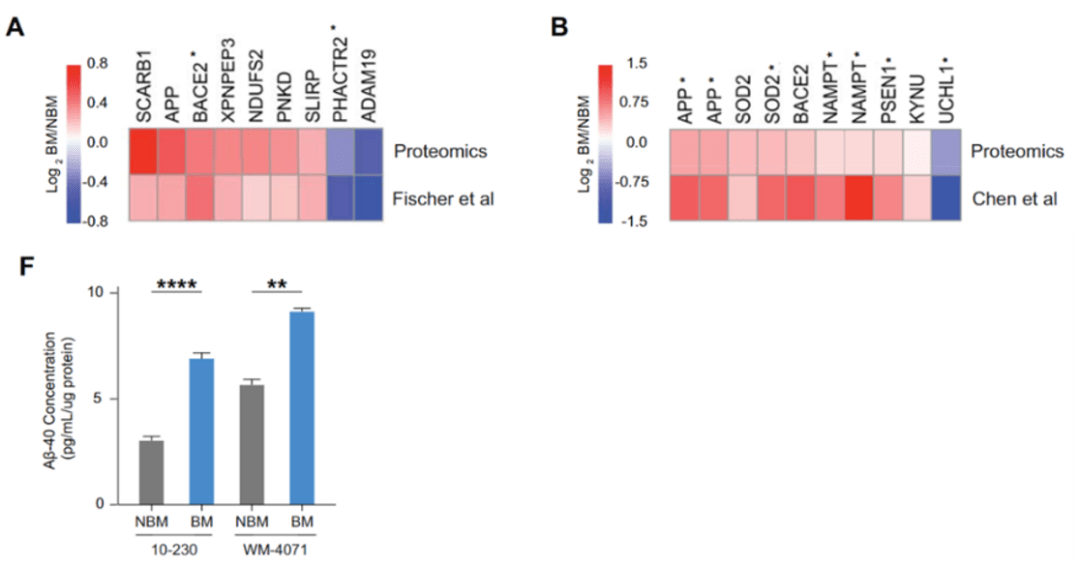
Hernando团队对差异表达蛋白质的进一步调研发现 ,脑转移灶肿瘤细胞高表达多种切割淀粉样前体蛋白(APP)的酶 , 如α-分泌酶(BACE2)和α-分泌酶复合物的催化亚基(PSEN1);而与 减少Aβ产生相关的酶则显著降低 , 如泛素连接酶UCHL1和ADAM19 。
那么黑色素瘤细胞是否能够分泌Aβ呢?Hernando团队检测了黑色素瘤细胞培养物上清中Aβ的含量 , 结果显示 脑转移灶的短期培养物上清中有更多的Aβ 。 鉴于Aβ可以对大脑产生影响 , 他们假设黑色素瘤细胞可能需要Aβ来帮助它们在大脑实质中存活和生长 。
文章图片
▲ A , B:脑转移黑色素瘤细胞高表达切割APP的酶;F:脑转移黑色素瘤细胞分泌更高水平的Aβ
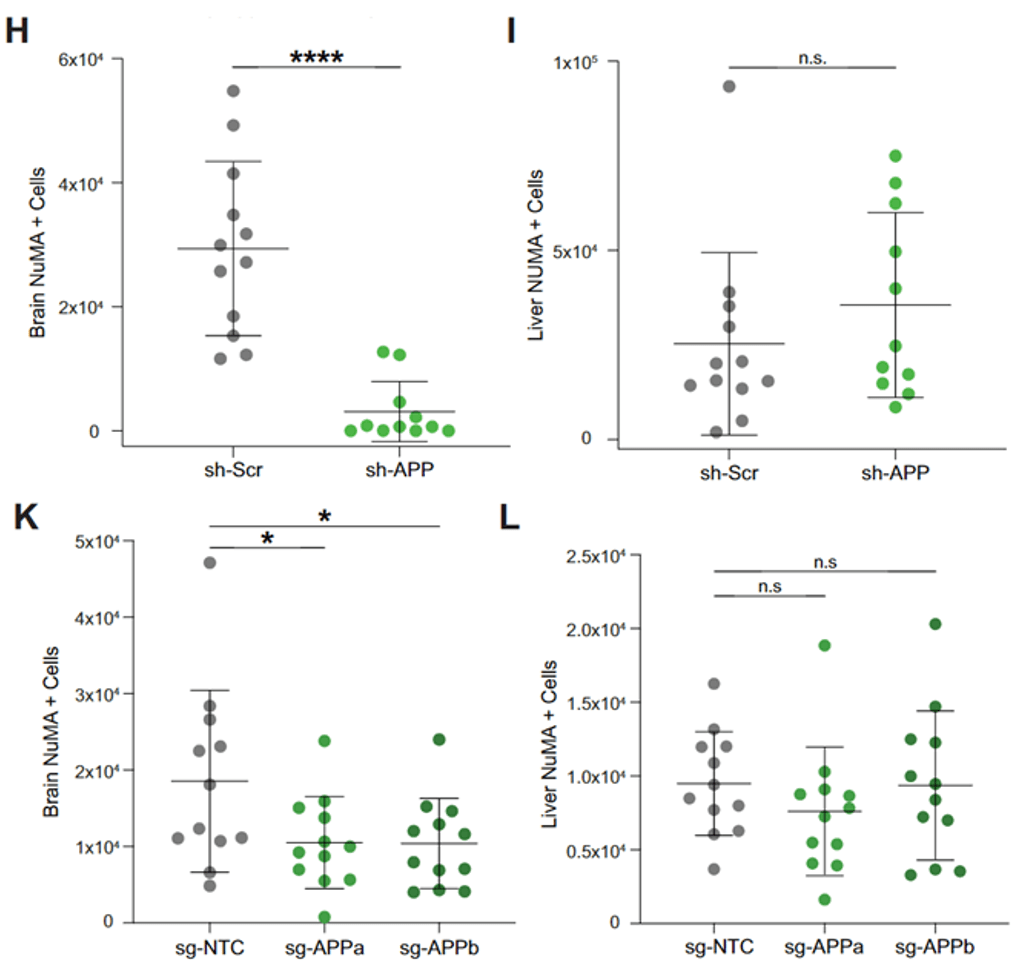
那么Aβ是否真的能影响黑色素瘤细胞的脑转移能力呢?Hernando团队敲低了黑色素瘤细胞中的APP , 发现 敲低APP的黑色素瘤细胞脑转移能力下降 , 但是颅外转移能力没有受到影响 。 这些结果提示 , APP是黑色素瘤细胞在大脑定植所必需的 。
文章图片
▲ 敲低APP后 , 肿瘤的脑转移能力显著下降
众所周知 , APP是Aβ的前体 , 它拥有多种加工形式 , 所以APP发挥作用的形式到底是哪一种呢?综合前述的研究结果 , Hernando团队假设Aβ是APP发挥作用的形式 。
为了验证这个猜想 , 他们进行了回补实验 。 向已经敲除APP基因的黑色素瘤细胞中转入突变型APP基因——SPA4CT-T43P——这种突变体基因表达产物主要是Aβ , 而不是APP的其他加工形式 。 结果显示 ,不论是回补野生型APP基因还是突变型APP基因 , 均能够恢复黑色素瘤细胞的脑转移能力 。 这说明 Aβ就是黑色素瘤脑转移所需的APP形式 。
- 综合征|【首儿医典】直立性蛋白尿
- 肾脏|【首儿医典】直立性蛋白尿
- 103岁老人,40年竟没进过医院 没吃一片药,只因做了一件事!
- 视网膜|合肥普瑞眼科科普|糖尿病竟然会引发这些眼病?你一定要知道
- 儿童染幽门螺杆菌,竟然影响发育?
- 女子|厦门30岁女子肺部长肿瘤,竟是一颗痣惹的祸?医生:要警惕
- 蛋白尿|【世界肾脏日】吾爱吾肾 知识强肾
- 肾脏|如何迅速降蛋白?医生道出2点“秘诀”,但不少人没意识到
- 【生活小贴士】惊!这样剪指甲竟会导致
- 癌细胞|44岁患癌,100岁仍健在,3个习惯或让秦怡战胜癌细胞,分享给你
