病毒|突破常识!病毒或成为阿尔茨海默病进展元凶?

文章图片
身兼免疫学家和企业家的Leslie Norins曾在3年前宣称 , 如果有哪位科学家能证明“病菌导致了阿尔茨海默病” , 就能获得100万美元奖金 。 此话一出 , 一石激起千层浪 , 有关阿尔茨海默病的致病机理再次引起了热议 。
尽管当下的主流理论认为阿尔茨海默病的根源是淀粉样蛋白沉积 , 但最近一些年来 , “感染论”开始逐渐受到了科学界的关注 。 这种理论认为 ,阿尔茨海默病的根源更可能是微生物感染 。
文章图片
-123RF -
【病毒|突破常识!病毒或成为阿尔茨海默病进展元凶?】两种理论看似水火不容 , 因为前者认为淀粉样蛋白的沉积会进一步诱发炎症反应 , 促使产生Tau蛋白缠结 , 最终损害、杀死神经元 。 不过 , “感染论”的支持者指出 , 有些人并没有患阿尔茨海默病 , 他们的大脑里却依然会出现淀粉样蛋白沉积 , 这些案例似乎更符合微生物感染 。
今日 , 《自然-通讯》的一项研究给“感染论”再添力证 , 来自德国神经退行性疾病研究中心研究者发现 , 病毒表面的糖蛋白可能会促进蛋白聚集体的扩散 。

文章图片
研究关注了一个比较新颖的方向: 蛋白致病种子(proteopathic seed) 的传播过程 。 这里的种子指代的便是病理性的蛋白沉积 , 它们不仅能在感染细胞中招募单体的病理蛋白使其成长成聚集体 , 还会借助 细胞外囊泡或是细胞间的直接接触传播到未受影响的细胞 。
这一过程仿佛是患者大脑中错误蛋白海啸般传播的复刻 。
通常情况下 , 细胞外囊泡能运输的病理性蛋白非常有限 。 但如果在病毒存在的情况下 , 形势则会有着大逆转 。 因为 病毒上的糖蛋白能起到帮助细胞结合的功能 , 增进细胞之间的联系 。
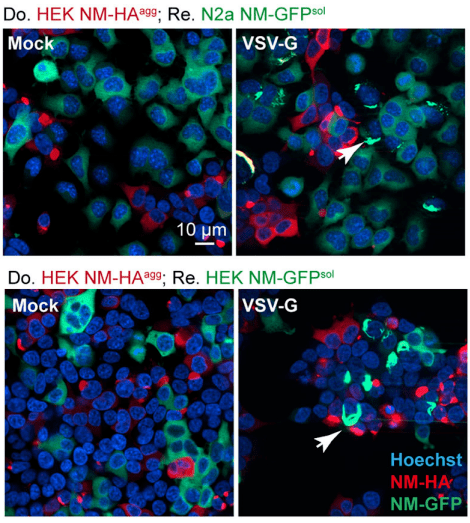
比如水泡性口炎病毒糖蛋白VSV-G就被认为能促进囊泡外运输 , 帮助货物转运到接收细胞中 , VSV-G能与几乎所有细胞表面都表达的LDL受体结合 。 而在新研究的测试中 , Ina M. Vorberg教授和同事发现 ,VSV-G可以显著提升细胞之间朊病毒的传播 , 朊病毒是一种突变的朊蛋白 , 传播时可以“感染”正常朊蛋白 , 并造成神经细胞大量死亡 。
文章图片
VSV-G可显著增强蛋白聚集体(红色)传播
—
参考资料[1]
研究构建的特殊细胞系显示 , 与转染了空载体的组别相比 , 当供体细胞转染了VSV-G之后 , 受体细胞中含有朊病毒聚集体的比例会显著提升 。 而不具备细胞结合力的突变VSV-G同样不能促进聚集体传播 。
具体来说 , VSV-G除了增强细胞间的接触 , 同样也会影响细胞外囊泡 , 事半功倍地传输朊蛋白聚集体 。 并且 ,细胞外囊泡可以说是蛋白聚集体传播的必须条件 , 一旦失去它 , 即使有VSV-G传播效率也会下降很多 。
研究同样分析了Tau蛋白聚集体 , 结果与朊病毒一样 , VSV-G的表达也可以助力Tau蛋白在细胞间的传播过程 。 更可怕的是 , 病毒糖蛋白介导的传播过程可以在不同细胞系间发生 。 比如朊病毒感染的神经瘤母细胞可以将蛋白聚集体传播到成纤维细胞中 。
文章图片
-药明康德内容团队制图 -
值得警惕的是 ,新冠病毒表面的刺突蛋白同样可以实现传播蛋白致病种子的功能 。 研究设计中 , 表达刺突蛋白的供体细胞可以显著地将Tau蛋白聚集体传播到表达ACE2受体(刺突蛋白的天然结合区)的细胞系中 。
- 接种|北京市累计报告接种新冠病毒疫苗5797.48万剂次
- 国家|全国累计报告接种新冠病毒疫苗293763.2万剂次
- 接种|北京累计接种新冠病毒疫苗2255.82万人
- 病毒|海淀病例所感染病毒与北美和新加坡等地部分毒株相似度较高
- 西溪医院|丽水市青田县通报一起新型冠状病毒肺炎复阳病例
- 病毒|氢气对慢性病意义大!
- 核酸|龙华医院解除闭环管理加开周日门诊,“因为你们,相信我们的城市能始终跑在病毒前”
- 新冠病毒疫苗加强针该怎么打?专家这样说
- 生活小常识:吃绿豆有什么好处
- 疫苗|新冠病毒疫苗加强针该怎么打?专家这样说
