预后
总生存期
自2000年以来 , 多发性骨髓的生存期已经得到显著改善 。 VRd方案治疗的生存期已达126.6个月 , 而2000年之前仅有30个月 。
尽管新诊断的多发性骨髓瘤的生存已显著提高 , 但大约20%的新诊断患者的预后明显较差 。
【治疗|JAMA:多发性骨髓瘤的诊断和治疗】修订版国际分期系统疾病结合了血清学肿瘤负荷生物标志物和遗传风险因素 , 以估计多发性骨髓瘤的预后(表2) 。
基因学风险分层
诊断时以下FISH结果与多发性骨髓瘤的无进展生存期和总生存期较差相关(也成为细胞遗传学高危):1q+、t(4;14)、t(14;16)、t(14;20)和del(17p)(TP53突变) 。 并且多种高危特征的共存 , 如del(17p)和1q + 的组合 , 可导致风险进一步增加 。
t(4;14)变化导致成纤维细胞生长因子受体3(FGFR3)基因过度表达 , 在新诊断为多发性骨髓瘤的患者中发生率约为7%-8% , 并且与无进展生存期和总生存期较差相关 。 Del(17p)是由于染色体17.41-43长臂上的肿瘤抑制基因p53缺失所致 , 5%~20%的患者发生Del(17p) , 它与多发性骨髓瘤患者预后更差有关 。 其他染色体改变如t(14;16) , 导致c-MAF癌基因灶过度表达 , 在新诊断多发性骨髓瘤的患者中发生率3%-5% 。
在复发性多发性骨髓瘤患者中 , 还可能出现新的FISH异常 , 从而提示存在克隆演变(定义为进行性获得越来越多的突变 , 导致疾病更晚期) 。 存在继发性del (17p)和/或肿瘤抑制基因双等位基因失活不良结局相关 。
其他的染色体异常改变可能包括超二倍体(定义为3、5、7、9、11、15、19和/或21号染色体三体) , 或发生率15%-20%的t(11;14) 易位 , 它可导致细胞周期蛋白D1过表达 。 但这些异常不导致预后差 。
新诊断MM的治疗
治疗的一般原则
多发性骨髓瘤的主要治疗目标是长期抑制恶性肿瘤 , 从而减轻疾病相关并发症 , 提高生存期和生活质量 , 治疗通常旨在降低骨髓中恶性浆细胞的数量(部分通过单克隆蛋白和血清游离轻链的水平进行测量) , 并且恶性浆细胞的大幅减少与更持久的疾病控制相关 。
多发性骨髓瘤治疗中最显著的进展是引入蛋白酶体抑制剂(如硼替佐米、卡非佐米、伊沙佐米)、免疫调节剂(如沙利度胺、来那度胺和泊马度胺)、针对骨髓瘤细胞表面抗原的单克隆抗体(如达雷妥尤单抗、elotuzumab和isatuximab)和自体造血干细胞移植(图2) 。
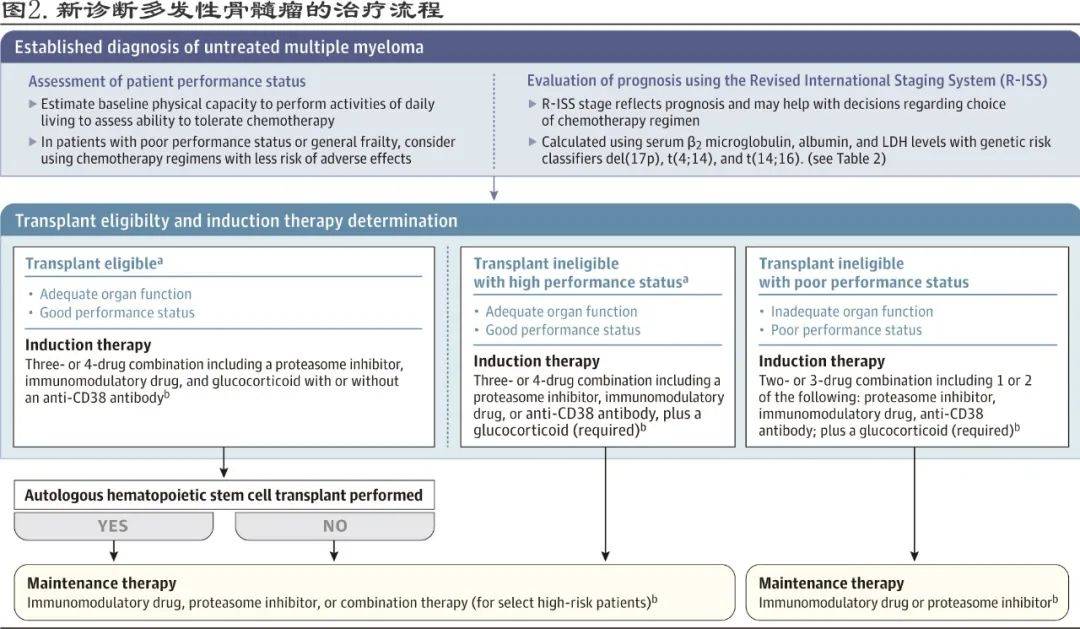
文章图片
在美国 , 适合移植和不适合移植的新诊断多发性骨髓瘤患者的标准一线治疗均为VRd 。 其他获批的主要治疗手段见表3 。
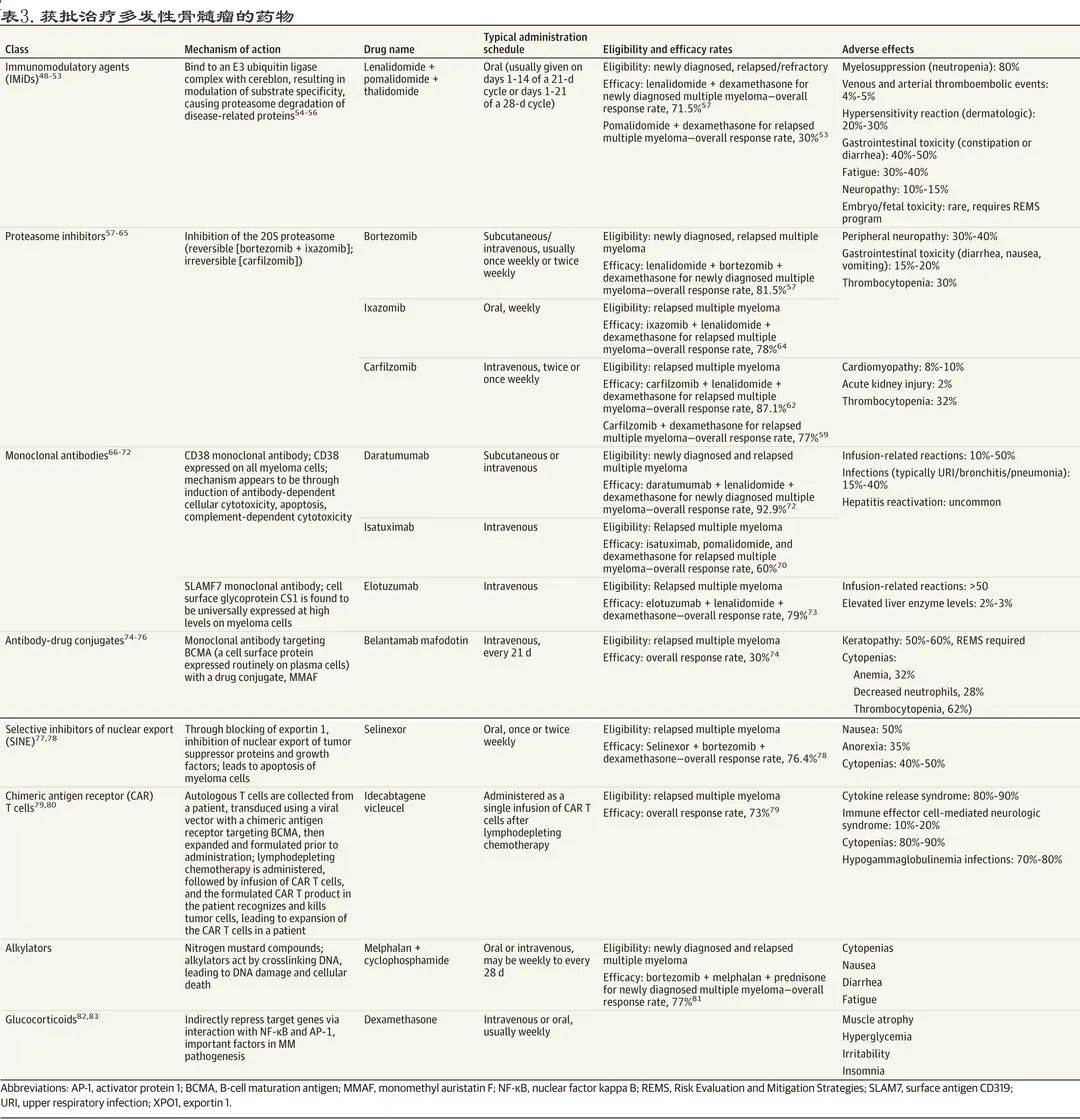
文章图片
新诊断多发性骨髓瘤治疗的主要临床试验总结见表4和表5 。
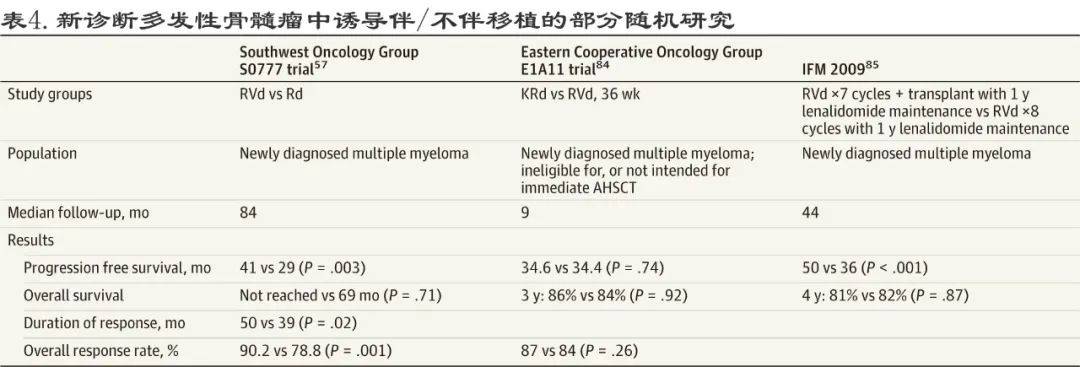
文章图片
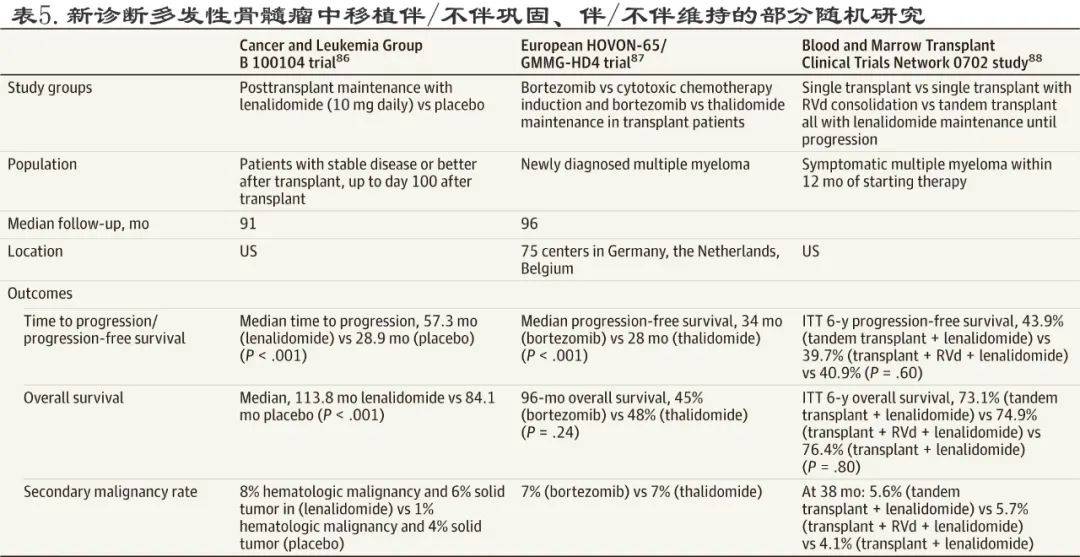
文章图片
一旦确诊多发性骨髓瘤 , 应启动初始(诱导)治疗 , 并评估自体造血干细胞移植 。 如果患者有足够的器官功能和良好的功能状态 , 则适合接受自体造血干细胞移植 。 年龄较大不是移植的禁忌症 , 尽管大多数接受手术的患者年龄小于70-75岁 , 此外严重的心脏、肺或肝脏疾病患者通常排除移植 , 但肾损害或衰竭患者仍可安全进行移植 。
适合移植患者
诱导、巩固和维持
适合移植的患者通常在移植前接受3-6个月的诱导治疗 , 移植后可以给予巩固治疗 , 指移植后的额外治疗周期 , 但不是标准实践 。 维持治疗是指低剂量抗骨髓瘤治疗 , 目标是在初始治疗后延长缓解 。
- 治疗|癌症晚期患者:死亡都是一种奢侈,真的太痛了!癌痛到底有多痛?
- 神经细胞|中科西部干细胞研究院:“干细胞”有望成为中风最好治疗方式!
- 症状|李俊才:运动神经元病怎么治疗能够达到控制病情?
- 团队|我国科学家在干细胞治疗糖尿病研究中获得重要进展!
- 团队|我国科学家在干细胞治疗糖尿病研究中获得重要进展
- 脂肪酸|肠道菌群紊乱还会引起糖尿病?如何治疗才最有效?解决方案来了!
- 治疗|提醒:真正对降糖有帮助的,只有这5个方法!
- 血管|体检查出这3种肝脏疾病,不要病急乱投医,以免过度治疗
- 治疗|乙肝新药NASVAC,已在国外注册免疫药物,研发走多学科合作之路
- 简单按摩体操 治疗痛经
