胃癌是全球第二大常见的恶性肿瘤 , 也是癌症患者死亡的第三大主要原因 。 目前 , 手术仍是最有可能治愈该疾病的方法 。 但是 , 由于早期诊断技术的缺乏 , 大多数胃癌患者在确诊时就已错过最佳的手术切除时间 , 使得化疗成为现阶段胃癌患者的首选方案 。
作为化疗药物之一的传统型紫杉类药物难溶于水 , 助溶剂会增加其毒副反应和降低化疗疗效 。白蛋白结合型紫杉醇( nab-紫杉醇 )是利用纳米技术将白蛋白作为载体来运输紫杉醇的新型药物 。 这种新剂型既能够提高药物的溶解性 , 又可以降低溶剂对患者的危害性 。 目前 ,nab-紫杉醇已被引入胃癌相关的临床试验 , 但结果往往因为耐药问题而效果不理想[1] 。 现阶段 , 胃癌患者对nab-紫杉醇耐药的分子机制急需解决 。
一般情况下 , 耐药主要分为原发性耐药和继发性耐药两种:原发性耐药指的是在化疗之前 , 肿瘤已具备的抗药能力;继发性耐药是指肿瘤在药物处理后才出现的抗药特征[2] 。 已有越来越多的研究表明 , 肿瘤干细胞(CSCs)参与肿瘤异质性和原发性耐药 , 靶向CSCs相关标记物、信号通路或微环境 , 有利于削弱肿瘤细胞的化疗抵抗性[3,4] 。
近日 , 由 复旦大学中山医院崔越宏和刘天舒领衔的研究团队在 Journal of Experimental & Clinical Cancer Research 期刊发表重要研究成果 。 他们发现 ZFP64/GAL-1信号通路能够抑制nab-紫杉醇对胃癌患者的治疗作用 , 并且抑制该通路也能够减弱肿瘤免疫抑制微环境 , 同时促进nab-紫杉醇对胃癌的治疗效果[5] 。

文章图片
▲ 论文首页
为了解决胃癌患者抵抗nab-紫杉醇治疗的问题 , 研究人员既比较了肿瘤组织与癌旁组织的差异表达基因 , 也比较了响应和不响应nab-紫杉醇治疗患者的肿瘤组织 , 随后将这两组所得的差异基因取了交集 , 从而 筛选到最显著改变的基因——ZFP64 。
他们发现: ZFP64表达量越高 , 患者的预后越差 。 此外Cox回归分析也显示ZFP64是胃癌患者的独立预后因素 。
▲ ZFP64与患者预后的关系
为了进一步确定ZFP64促进胃癌患者抵抗nab-紫杉醇 , 研究人员首先基于临床数据发现 ZFP64与肿瘤转移有关 。 其次 , 通过体外实验证明 ,敲低ZFP64确实能够抑制肿瘤细胞的迁移和侵袭 , 以及下调上皮间充质转化(EMT)相关标志物 。
除此之外 , RNA-seq的通路富集结果也发现ZFP64与凋亡途径、肿瘤干性存在一定联系 , 并经实验验证确实如此 。
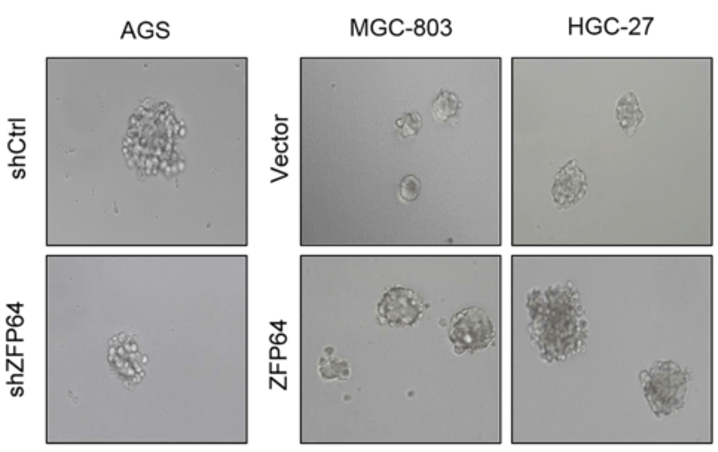
文章图片
▲ ZFP64降低肿瘤细胞的成球能力(与肿瘤干性有关)
随后 , 体内实验也证明: ZFP64表达量越高 , 肿瘤对nab-紫杉醇的药物敏感度就越低 。
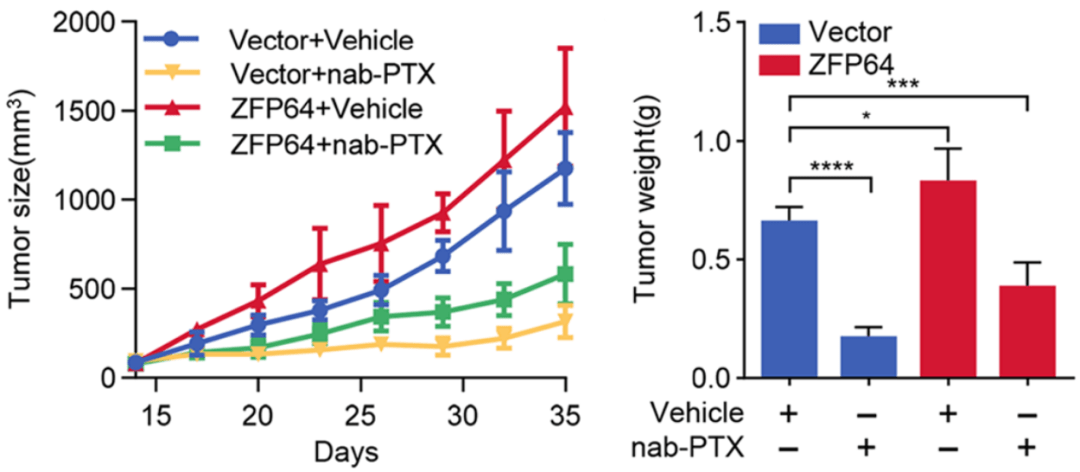
文章图片
▲ ZFP64促进肿瘤对nab-紫杉醇的抵抗性
在发现ZFP64基因确实影响nab-紫杉醇对胃癌患者的治疗后 , 接下来就要搞清楚为什么?!以及how?!
目前已有文章报道ZFP64可以作为转录因子[6] , 于是研究人员猜想:ZFP64在胃癌中是否也同样会扮演转录因子的角色呢?如果是 , 被ZFP64调控的靶基因是否与肿瘤耐药相关呢?
于是 , 他们通过ChIP-seq数据以及比较了与ZFP64过表达正相关的差异基因 ,找到了GAL-1 。 目前 , 已知GAL-1功能也确实与肿瘤干性和免疫调控有关[7,8]!经实验验证 , 敲低胃癌细胞的GAL-1后 , 的确能够促进nab-紫杉醇的药理杀伤作用 , 以及抑制由ZFP64过表达诱导的肿瘤干细胞特征 。
- 家长|复旦儿科MDT团队巧取胃内巨大结石 4岁女童转危为安
- 樊嘉|复旦大学附属中山医院落子大丰,项目总投资10亿元
- 复旦大学|“平移技术和理念 实行同质化管理”盐城大丰与复旦大学附属中山医院合作共建苏北健康管理中心
- 复旦|广东省人民医院新急诊科启用,含急诊ICU床位14张
- 复旦大学|复旦大学附属中山医院心内科教师团队获评第二批全国高校黄大年式教师团队
- 团队|“第二批全国高校黄大年式教师团队”出炉 复旦大学附属中山医院心内科教师团队入选
- 上海复旦|活到112岁的名媛,不爱锻炼,喜欢吃肉,养生秘诀只有十个字!
- dn32岁复旦女博士患癌,8次化疗离世,她死前的一个反思,令人警醒
- 小义|20分钟让17岁少年“重生”!复旦儿科完成华东首例儿童经右心室肺动脉支架瓣膜植入术
- 大脑背腹侧语言通路中断可引发严重失语
