文章图片
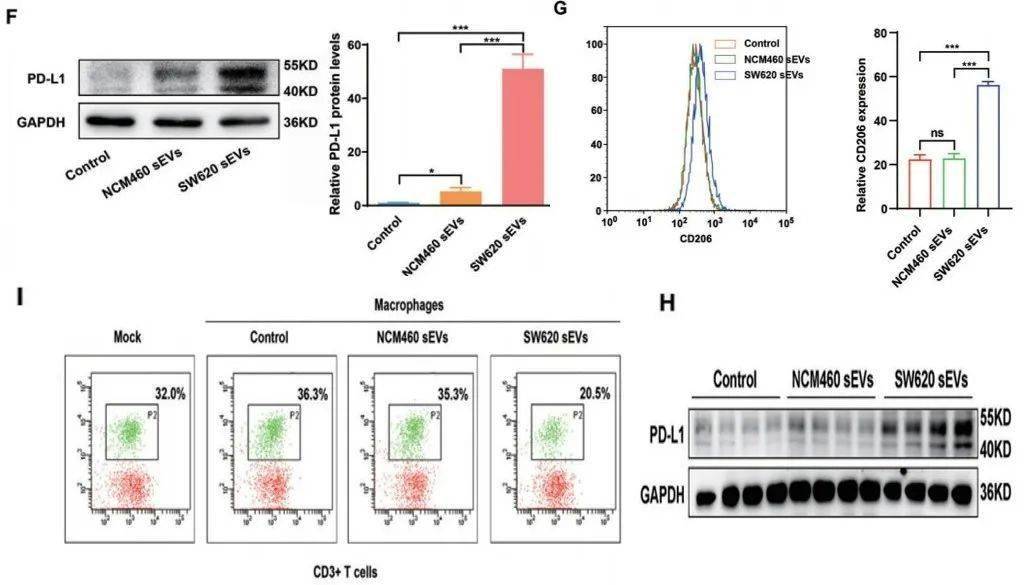
巨噬细胞经肠癌细胞来源的小细胞外囊泡(sEVs)共培养处理后 , 图F:PD-L1表达增加;图G:表现出M2样表型;图I:与淋巴细胞共培养 , 能降低CD8+T细胞的比例 。 图H:肠癌来源的sEVs注射至小鼠 , 体内巨噬细胞中PD-L1的表达上调
小细胞外囊泡携带复杂的生物分子 , 包括蛋白质、脂质和核酸 。 其中 , miRNA被认为是最重要的信号分子之一 。 研究人员又大胆推测 , 肠癌细胞分泌的小细胞外囊泡对巨噬细胞的调控作用 , 是通过囊泡内的miRNA来介导的 。
研究人员对肠癌来源小细胞外囊泡内的miRNA进行了筛选 。 在肠癌细胞系和肠癌患者中 , 有四种miRNA显著富集 , 将它们分别转染至巨噬细胞 , 只有miR-21-5p和miR-200a能使巨噬细胞发生M2极化 , 上调PD-L1表达 。
为了进一步验证这两种miRNA对巨噬细胞的影响 , 研究人员进行了功能缺失实验 。肠癌细胞经过miR-21-5p和miR-200a敲除后 , 与巨噬细胞共培养 , 发现巨噬细胞M2表型减弱 , PD-L1表达下调 , 再与淋巴细胞共培养 , 则CD8+T细胞的比例增加 , 功能增强 。
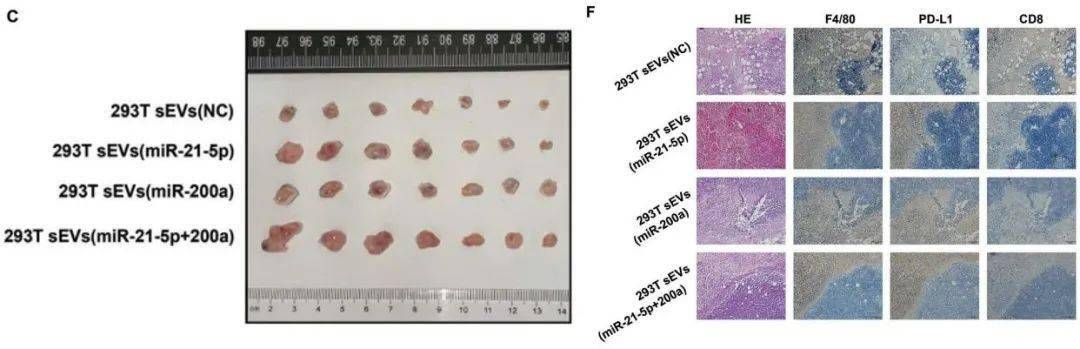
最后 , 研究人员又在体内验证了两种miRNA的功能 。 小鼠成瘤实验的结果显示 , 注射miR-21-5p和(或)miR-200a的小鼠 , 肿瘤生长得更大 , 组织中PD-L1+巨噬细胞更多 , CD8+T细胞更少 。
文章图片
注射miR-21-5p和(或)miR-200a的小鼠 , 肿瘤生长得更大(图C) , 组织中PD-L1+巨噬细胞更多 , CD8+T细胞更少(图F)
这些数据表明 ,肠癌细胞分泌的小细胞外囊泡内的miR-21-5p和miR-200a , 能诱导巨噬细胞PD-L1表达和M2极化 , 导致CD8+T细胞活性下降 , 促进肠癌的发生发展 。
那么 , miR-21-5p和miR-200a , 又是作用于什么信号通路来发挥作用的呢?
生信分析发现 ,PTEN是miR-21-5p和miR-200a的潜在靶点 , SOCS1是miR-21-5p的潜在靶点 。 实验验证 , miR-21-5p能显著抑制PTEN和SOCS1的表达 , 增加巨噬细胞中p-AKT和p-STAT1的表达 , miR-200a能明显抑制PTEN的表达 , 使巨噬细胞中的p-AKT表达上调 。 敲除PTEN和SOCS1都能诱导巨噬细胞发生M2极化 , 降低CD8+T细胞比例 。
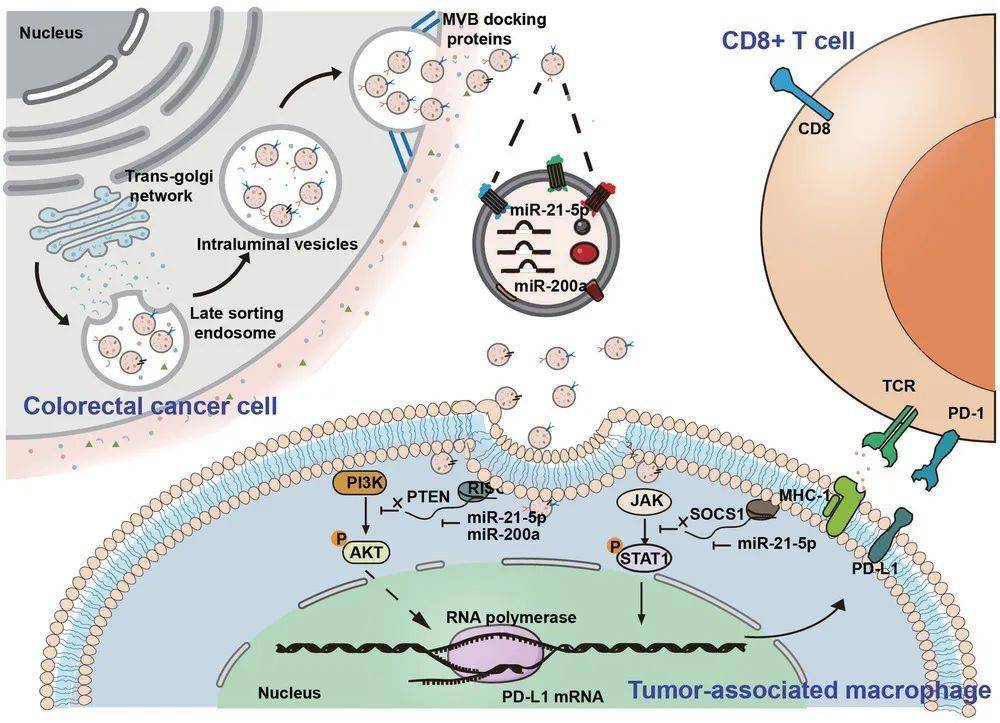
至此 , 机制揭示清晰 ,肠癌细胞分泌小细胞外囊泡 , 囊泡内的miR-21-5p和miR-200a , 通过PTEN/AKT和SCOC1/STAT1途径 , 协同诱导PD-L1在巨噬细胞中的表达 , 从而抑制CD8+T细胞功能 。
文章图片
本研究机制示意图
综上所述 , 黄朝晖教授团队从肠癌的临床病理特点出发 , 从肿瘤微环境的角度入手 , 通过丝丝入扣的实验 , 层层深入地揭示了肠癌细胞的免疫逃逸新机制 , 为肠癌的免疫治疗提供了一个新思路 。 从研究方法上看 , 本研究是一则优秀的“from bedside to bench”研究范例;从研究结果上看 , 阻断肿瘤相关巨噬细胞中的PD-L1信号 , 有望成为肠癌治疗的一个新方向 。
参考文献
[1] Fitzgerald RC, di Pietro M, O'Donovan M, et al. Cytosponge-trefoil factor 3 versus usual care to identify Barrett's oesophagus in a primary care setting: a multicentre, pragmatic, randomised controlled trial. Lancet. 2020;396(10247):333-344. doi:10.1016/S0140-6736(20)31099-0
[5] O'Malley G, Treacy O, Lynch K, et al. Stromal Cell PD-L1 Inhibits CD8+ T-cell Antitumor Immune Responses and Promotes Colon Cancer. Cancer Immunol Res. 2018;6(11):1426-1441. doi:10.1158/2326-6066.CIR-17-0443
【相关|江南大学/复旦大学团队揭露肠癌“改造”巨噬细胞全程!】
- 检测|山东烟台1例无症状感染者相关人员核酸检测均为阴性
- 相关原则|“医疗机构检查结果互认”是一份民生“大礼包” | 新京报快评
- 相关|辽宁葫芦岛全域低风险 仍需严格执行当地相关防疫措施
- 本文转自:上观最近黑芝麻丸相关话题冲上热搜了!一颗平平无奇的黑芝麻丸|黑芝麻丸防脱?想多了!吃太多还可能.....
- 好睡眠与睡觉朝向紧密相关
- 相关性|舒泰神:BDB-001注射液(ANCA相关性血管炎适应症)完成首例受试者给药
- 相关|含胶原蛋白、玻尿酸,网红奶茶们都能“美颜”了?
- 相关|吃肉,最好每周不超5次
- 疫情|太原市疫情防控办发布通告 对相关区域分类管理
- 相关|成都高新南区暂停影剧院、培训机构等室内场所运营活动
