结直肠癌是严重危害全球的公共健康难题 , 发病率和死亡率均位居癌症前三[1] 。 近年来研究发现 , 结直肠癌的发生发展与肿瘤免疫逃逸密切相关 , 然而 , 相关具体机制尚未彻底阐明 。
肿瘤细胞往往通过营造独特的肿瘤微环境来逃避免疫[2] 。 在肿瘤微环境中 , 巨噬细胞是最丰富的免疫细胞 , 而且能随肿瘤微环境的变化而改变 , 极化为M1表型或M2表型 。 其中 , M2表型的巨噬细胞能抑制局部免疫 , 促进肿瘤免疫逃逸和进展[3] 。
近日 , 江南大学医学院黄朝晖教授和复旦大学黄胜林团队 , 针对肠癌细胞利用巨噬细胞免疫逃逸的机制 , 在国际顶尖医学期刊 Advanced Science 上发表重要研究成果[4] 。

文章图片
官网论文首页截图
他们发现 , 肠癌细胞能分泌小细胞外囊泡 , 囊泡内的miR-21-5p和miR-200a通过PTEN/AKT和SCOS1/STAT1途径 , 诱导肿瘤相关巨噬细胞发生M2样极化 , 上调PD-L1表达 , 进而导致CD8+T细胞活性下降 , 实现免疫逃逸和肿瘤生长 。
首先 , 研究人员分析了肠癌临床样本 , 发现 越靠近癌症组织中心 , M2样巨噬细胞的密度也就越高 。 体外实验共培养巨噬细胞和肠癌细胞后 , 巨噬细胞极化为M2表型 。 这提示巨噬细胞在浸润肠癌组织的过程中发生了表型转变 。
随后进一步的生信分析发现 ,随肠癌病情的进展 , 发生M2极化的肿瘤相关巨噬细胞比例升高 , 免疫抑制信号通路富集 , PD-L1表达水平上调 。 生存分析发现 , M2样巨噬细胞的PD-L1表达和肠癌预后不良显著相关 。
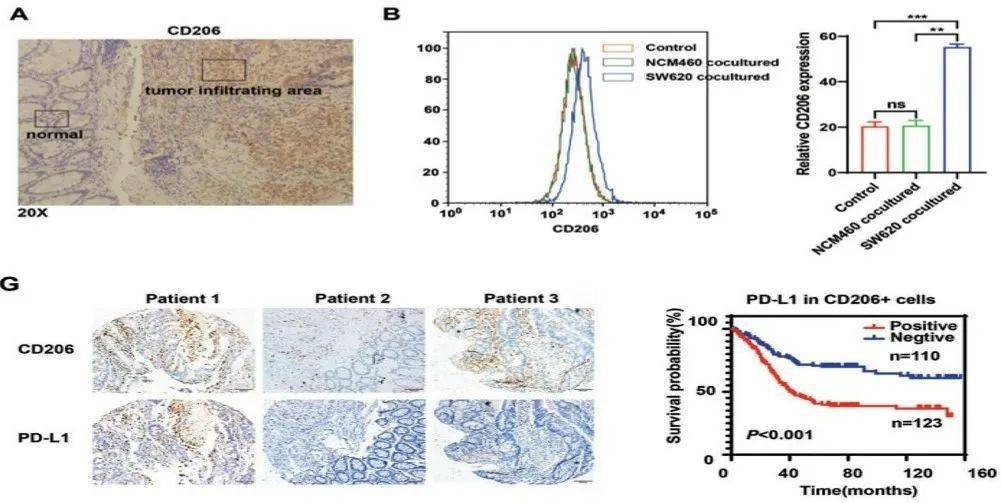
文章图片
图A:M2样巨噬细胞的密度在肠癌组织中心远高于在组织边缘(CD206为巨噬细胞M2极化的标志物);图B:与正常肠上皮细胞(NCM460)共培养相比 , 和肠癌细胞(SW620)共培养的巨噬细胞呈现M2样改变;图G:M2样巨噬细胞PD-L1表达阳性的肠癌患者预后不良
PD-L1作为PD-1的配体 , 能与T细胞的PD-1结合 , 诱导T细胞失能和凋亡 , 进而抑制肿瘤抗原特异性CD8+T细胞的激活、增殖和抗肿瘤功能[5] 。
那么 , 在肠癌中 , 巨噬细胞发生M2极化后 , 是否是通过表达PD-L1来抑制CD8+T细胞 , 进而发挥免疫抑制作用?
研究人员把巨噬细胞经肠癌细胞共培养处理后 , 再与淋巴细胞共培养 , 发现巨噬细胞PD-L1表达上调 , CD8+T细胞比例下降 , 而在共培养过程中添加抗PD-L1抗体则能抑制CD8+T细胞比例的降低 。 此外 , 在肠癌病理组织中 , PD-L1+M2样巨噬细胞浸润得越多 , CD8+T细胞的比例就越低 。
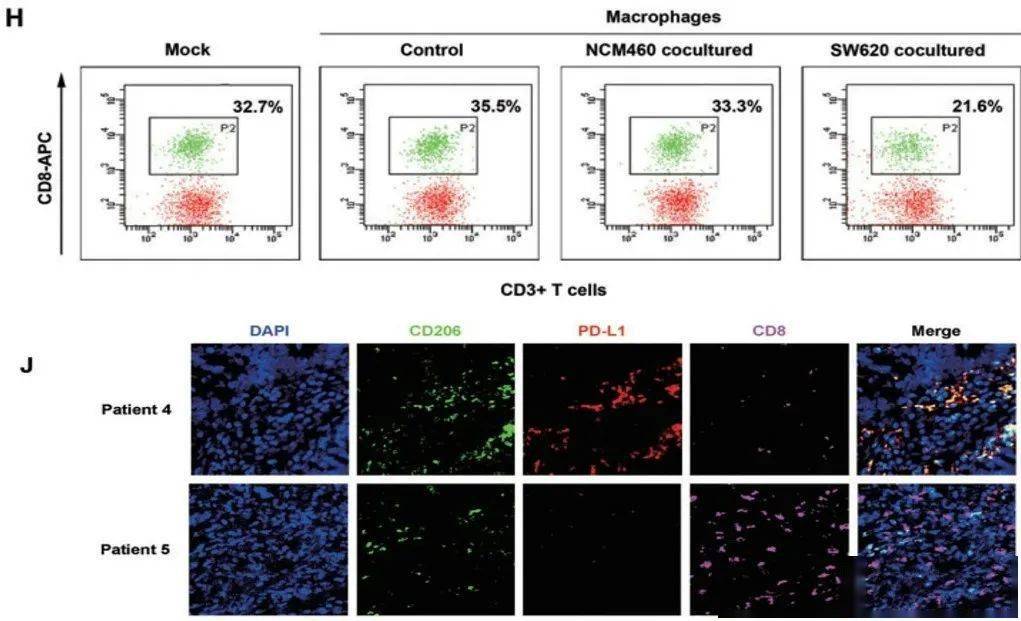
文章图片
图H:巨噬细胞经肠癌细胞共培养处理后 , 再与淋巴细胞共培养 , 能降低CD8+T细胞比例;图J:肠癌组织中 , PD-L1+M2样巨噬细胞和CD8+T细胞的比例呈反比
这些结果表明 ,肠癌细胞能诱导巨噬细胞发生M2极化 , 表达PD-L1 , 抑制CD8+ T细胞 。
但是 , 肠癌细胞又是通过何种途径来诱导巨噬细胞呢?
小细胞外囊泡是细胞分泌的直径为30-150纳米的细胞外囊泡 , 是细胞间信号传导的重要载体[6] 。 之前的研究发现肿瘤细胞外囊泡和免疫逃逸关系密切 , 据此 , 研究人员推测 , 肠癌细胞通过分泌小细胞外囊泡来调控巨噬细胞 , 以逃逸免疫 。
随后 , 研究人员进行了实验 , 验证了假说 。 在体外共培养实验中 ,巨噬细胞经肠癌细胞来源的小细胞外囊泡共培养处理后 , 表现出M2样表型 , PD-L1表达增加 , 再与淋巴细胞共培养 , 能降低CD8+T细胞的比例;在体内实验中 , 小鼠经注射肠癌细胞来源的小细胞外囊泡后 , 体内巨噬细胞的PD-L1表达上调 。
- 检测|山东烟台1例无症状感染者相关人员核酸检测均为阴性
- 相关原则|“医疗机构检查结果互认”是一份民生“大礼包” | 新京报快评
- 相关|辽宁葫芦岛全域低风险 仍需严格执行当地相关防疫措施
- 本文转自:上观最近黑芝麻丸相关话题冲上热搜了!一颗平平无奇的黑芝麻丸|黑芝麻丸防脱?想多了!吃太多还可能.....
- 好睡眠与睡觉朝向紧密相关
- 相关性|舒泰神:BDB-001注射液(ANCA相关性血管炎适应症)完成首例受试者给药
- 相关|含胶原蛋白、玻尿酸,网红奶茶们都能“美颜”了?
- 相关|吃肉,最好每周不超5次
- 疫情|太原市疫情防控办发布通告 对相关区域分类管理
- 相关|成都高新南区暂停影剧院、培训机构等室内场所运营活动
