阿尔茨海默病|《科学》:阿尔茨海默病重大突破!科学家首次看清人脑Aβ42结构,并发现体内结构与体外存在差异,实验室工作需革新丨科学大发现
阿尔茨海默病(AD)的药物研发一直十分困难 , 特别是以β淀粉样蛋白(Aβ)为靶点开发的药物 , 成功率极低 。
那么原因是什么呢? 药物研发使用的分子及动物模型与真实病理状态的差异可能是关键 。
近期 ,Aβ的研究取得了新的进展 , 为AD药物研发带来了新的希望 。
英国剑桥大学的Michel Goedert教授、Sjors Scheres教授、Benjamin Falcon教授联合美国印第安纳大学Bernardino Ghetti教授在《科学》杂志上发表了他们关于Aβ结构的最新研究结果[1] 。
研究人员展示了人脑中Aβ42纤维的冷冻电镜(cryo-EM)结构 。 两种结构相关的S形原丝褶皱产生了两种类型的细丝 。I型细丝主要在散发性阿尔茨海默病患者的大脑中发现 , II型细丝则在家族性阿尔茨海默病患者和其他情况下发现 。大脑中的Aβ42细丝的结构与体外组装的细丝不同 。
这意味着 , Aβ聚集抑制剂以及Aβ诊断试剂的研发出现了新的机遇 。

文章图片
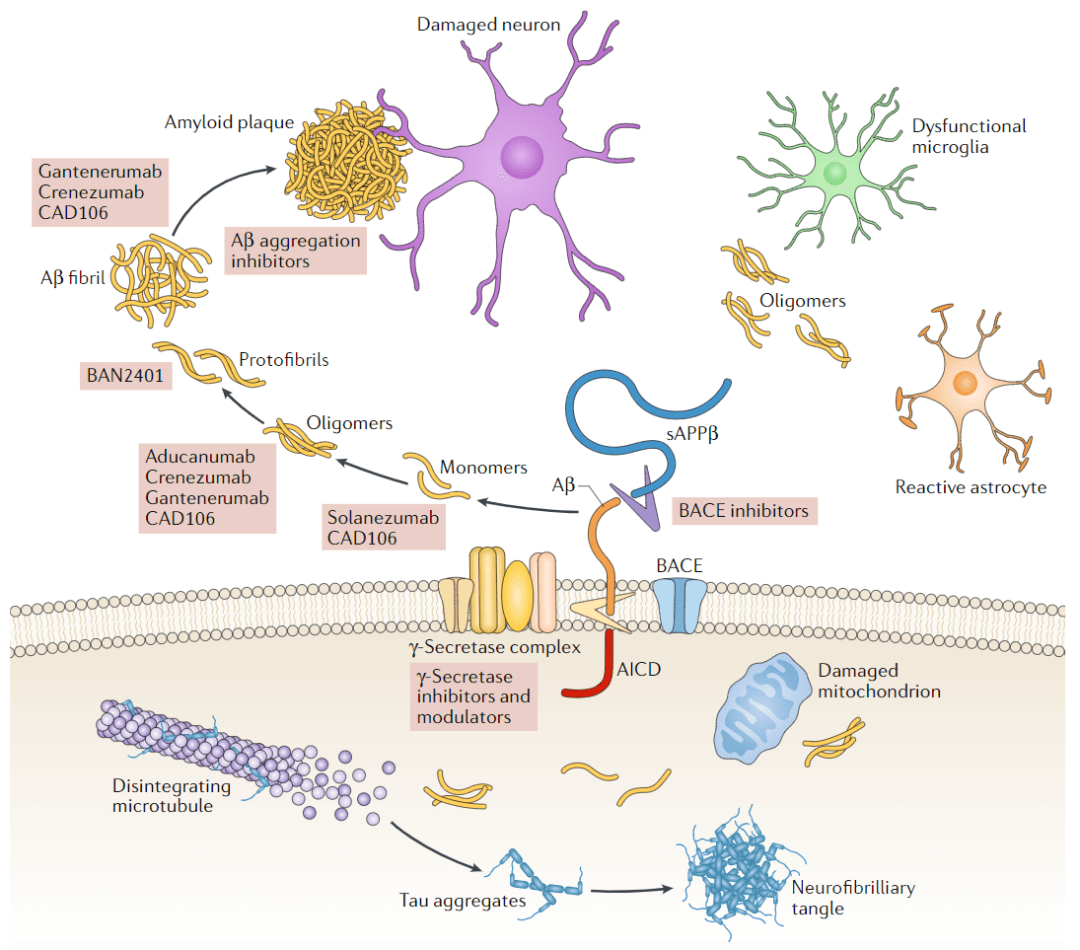
阿尔茨海默病(AD)是一种常见的神经退行性疾病 , 主要表现为认知障碍和记忆损伤 , 可以分为家族型和散发型 。 AD患者脑内同时存在两种丝状淀粉样沉淀物 , 分别是Aβ蛋白斑块以及神经纤维缠结[2] , 其中Aβ的产生对AD的发病至关重要[3] 。
【阿尔茨海默病|《科学》:阿尔茨海默病重大突破!科学家首次看清人脑Aβ42结构,并发现体内结构与体外存在差异,实验室工作需革新丨科学大发现】在家族型AD患者体内 , 存在着Aβ前体蛋白APP基因和早老素PSEN1和PSEN2基因的突变 。 APP经过β分泌酶和γ分泌酶两步剪切形成Aβ , 其中早老素与γ分泌酶有关 。 Aβ存在不同氨基酸数目的单体 , 主要包括Aβ40和Aβ42[4,5] 。
不论是Aβ40还是Aβ42 , 都会发生进一步的聚集 。 由于疏水氨基酸的存在 , Aβ单体互相聚集形成富含β-片层结构的寡聚体 。 Aβ寡聚体包括小的低聚物 (二聚体和三聚体) , 中等大小的寡聚体 (9聚体, 12聚体, Aβ衍生的可扩散配体等)和高分子量的寡聚体 (原丝)[6] 。淀粉样斑块中原丝或寡聚体间的疏水氨基酸进一步作用形成纤维(细丝) , 纤维堆叠在一起形成斑块 。
文章图片
由于Aβ42C末端两个疏水氨基酸的存在 , 使得Aβ42比Aβ40更易聚集 , 而且更易形成寡聚体[7] 。 在AD的相关研究中 , Aβ寡聚体与神经毒性更为相关[8] , 因此 Aβ42相比Aβ40具有更大的神经毒性 。
AD患者脑内Aβ的沉积主要可以分为三类 , 实质中的弥漫性沉积、局灶性沉积以及血管沉积 。 实质的沉积发生在不同的脑区 , 而冷冻电镜技术已经提供了来自AD患者淋巴管中Aβ40聚集体的结构[9] , 然而分散的斑块和致密核外部的细丝主要是Aβ42 (尽管Aβ40产生的更多) , 但其结构仍未被阐明 。
研究人员从10例尸检样本中提取Aβ42的细丝结构 。 10例样本中 , 有5名AD患者 , 其中3例散发型2例家族型;5名其他患者为1例Tau星形胶质细胞病变(ARTAG)、1例帕金森痴呆(PDD)、1例路易体痴呆(DLB)、1例额颞叶痴呆(FTD)以及1例病理衰老患者(PA ) 。
研究人员在散发型AD患者中观察到了I型丝 , 这种细丝由两条相同的S形原丝通过延伸的臂面对面拥抱组成 , 原丝的二级结构由5条β链组成 , S形区域围绕两个疏水簇折叠 。在家族性AD患者中 , 观察到了II型丝 , 其原丝界面较小 , 原丝界面主要由静电相互作用稳定 。 与AD患者淋巴管内Aβ的结构不同 , 不论是I型还是II型都具有左旋扭曲 。
- 阿尔茨海默病|春天了,有钱没钱,女人要多吃它,健脾胃补气血,滋润肌肤气色好
- 咬肌|咬肌越有力患阿尔茨海默病风险越低
- 如何照护阿尔茨海默病患者?
- 本文转自:新民晚报陆文静(右二)和同学带领白领体验音乐治愈课程曾几何时|用音乐抚慰“曾经的少年” 上音音乐治疗师服务阿尔茨海默症患者
- 渤健公司|又现死亡病例,阿尔茨海默病还有没有救?
- 闫龑|阿尔茨海默病患者的照护要点
- 阿尔茨海默病|一天喝二两酒,不贪杯,过了一段时间后,对身体有什么影响?
- 蛋白|阿尔茨海默症或与睡眠有关?科学家这样解释
- 障碍|睡眠障碍要重视!阿尔茨海默病相关研究又有新发现
- 阿尔茨海默|揭示阿尔茨海默病认知衰退的“罪魁祸首”
