胆结石|肺癌复发风险降低34%!PD-L1抑制剂Tecentriq获FDA优先审评资格!
文章图片
文章图片
Tecentriq是一种单克隆抗体 , 能与在肿瘤细胞和肿瘤浸润免疫细胞上表达的PD-L1蛋白靶向结合 , 阻断其与PD-1和B7.1受体的相互作用 , 从而重新激活免疫T细胞 , 以杀伤肿瘤细胞 。
商品名:Tecentriq(特善奇)
通用名:Atezolizumab(阿替利珠单抗/阿特珠单抗)
美国首次获批:2016年5月
【胆结石|肺癌复发风险降低34%!PD-L1抑制剂Tecentriq获FDA优先审评资格!】中国首次获批:2020年2月
获批适应症:三阴性乳腺癌、尿路上皮癌、非小细胞肺癌(中国)、小细胞肺癌(中国)、肝癌(中国)
NSCLC推荐剂量:1200 mg每次 , 每3周静脉注射一次 , 每次60分钟以上 。 如果联合使用 , 则在化疗或使用其他抗肿瘤药物的同一天先使用阿特珠单抗 。
临床数据该项申请是基于一项全球性III期IMpower010临床试验获得的积极中期分析结果 。 该试验共入组1005例患者 , 旨在肿瘤表达PD-L1的IB-IIIA期非小细胞肺癌患者(ECOG评分为0 ~ 1)中 , 评估接受手术切除和长达4个周期的含铂化疗后 , 与最佳标准治疗(BSC)相比 , Tecentriq的疗效和安全性 。
该研究的主要终点是研究者评估的意向治疗(ITT)人群的无病生存期(DFS);次要终点包括ITT人群的总生存期(OS) , PD-L1肿瘤细胞表达50%或更高以及II期至IIIA疾病患者的DFS , 以及所有患者人群的3年和5年DFS率 。
入组患者的人群特征包括:中位年龄为62岁(范围26-84岁) , 其中38.0%的患者年龄在65岁或以上 。 此外 , 66.9%的患者为男性 , 73.4%为白人 , 55.3%的ECOG评分为0 。 此外 , 65.6%的患者组织学为非鳞状 , 12.2%为IB期 , 54.6%的患者PD-L1肿瘤细胞表达为1%或更高 。
试验结果表明 , 与最佳标准治疗相比 , Tecentriq可将患者疾病复发的风险降低34%(HR=0.66 , 95% , 置信区间:0.50-0.88) 。
在中位随访时间为32.8个月时 , Tecentriq组 VS 最佳标准治疗组的PD-L1≥1%的II-IIIA期人群的中位无病生存期(DFS)为无法评估(NE) VS 35.3个月 。 1年DFS率为74.6% VS 61%;3年DFS率为60% VS 48.2% 。
图注:Tecentriq治疗肿瘤表达PD-L1≥1%的II-IIIA期NSCLC患者的临床数据
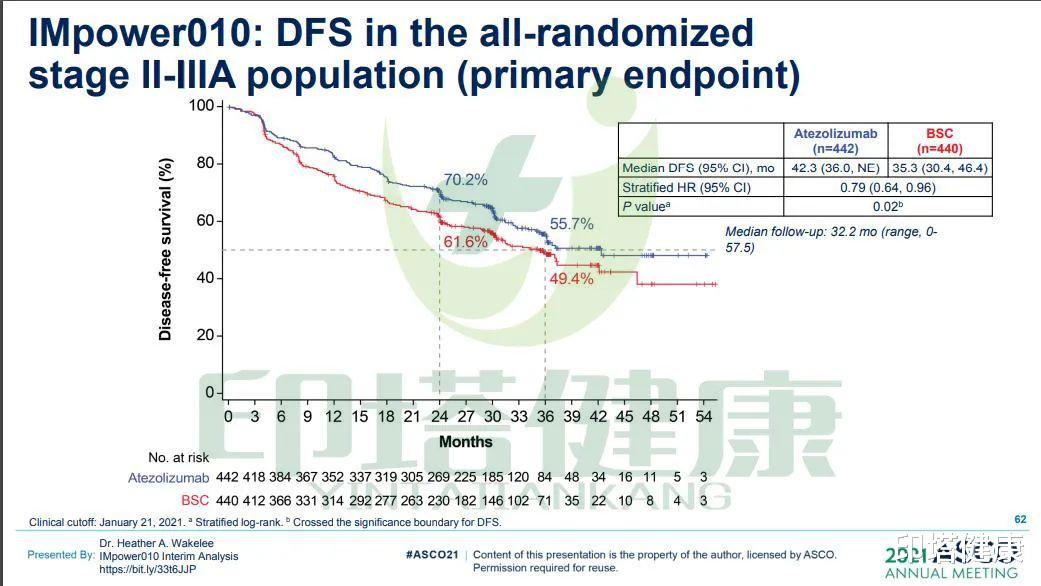
在2021年ASCO年会上提供的其他数据显示 , 在中位随访时间为32.2个月 , 两组(Tecentriq组 VS 最佳标准治疗组)全随机II期至IIIA人群的中位DFS为42.3个月 VS 35.3个月 。 1年DFS率为70.2% VS 61.6%;3年DFS率为55.7% VS 49.4% 。
图注:Tecentriq治疗所有随机II-IIIA期NSCLC患者的临床数据
在中位随访时间为32.2个月时 , ITT人群(IB-IIIA期)的中位DFS为无法评估(NE) VS 37.2个月 。 1年DFS率为71.4% VS 63.6%;3年DFS率为57.9% VS 52.6% 。
图注:Tecentriq治疗ITT人群(IB-IIIA期)的临床数据
在进行预先计划的DFS中期分析时 , OS数据尚不成熟 , ITT人群的OS未经过正式测试 。 然而 , 在PD-L1肿瘤细胞表达为1%或更高的II - IIIA期患者中 , 观察到Tecentriq组的OS改善趋势(HR为0.77;95%, 置信区间为0.51-1.17) 。
- 胶质瘤是脑内最常见的恶性肿瘤之一|胶质瘤能治好吗?复发后有必要再次手术吗?医生说了实话
- 复发|妇产科专家:女性妇科炎症复发,5种食物少吃,妇科炎症容易恶化
- 脱发|生发吃什么好?防脱吃什么好?恢复发量吃什么好?
- 疫情|天津危重病例:为肺癌患者,未接种疫苗
- 人员|天津确诊1例危重病例:为肺癌患者,入院时体温38℃,神志不清
- 呼之|天津确诊危重病例为未打疫苗肺癌患者
- 林锦|天津确诊1例新冠肺炎危重病例?为肺癌患者,未接种疫苗
- 接种|天津确诊1例新冠肺炎危重病例?为肺癌患者,未接种疫苗
- 疫苗|天津确诊1例新冠肺炎危重病例:为肺癌患者,未接种疫苗
- 癌症|癌症复发有一个高峰期,很多人往往都忽略了,中医数十年经验分享
