免疫检查点抑制剂(ICIs)作为当前免疫疗法的主力之一 , 在多种肿瘤的治疗中都似乎都有着亮眼的表现 。 不久前美国FDA已批准纳武利尤单抗及帕博利珠单抗作为进展期胃食管腺癌(GEAC)的一线治疗 , 而 帕博利珠单抗用于人类表皮生长因子受体2(HER2)阳性胃癌患者的治疗也得到了快速批准[1] 。
然而 ,由于肿瘤免疫微环境的高度异质性 , 免疫治疗对肿瘤的总体有效率仍不够理想 , 而免疫治疗与其他治疗方案的联合也并非都能达到协同性的效果 。 事实上 , 当前有关ICIs联合多种治疗手段的研究层出不穷 , 人们似乎更为关注免疫联合治疗所带来的经济学影响 。 这也促使研究者们需要筛选出真正能从免疫治疗中受益的群体 , 从而真正改善肿瘤患者的预后 。
既往研究发现在PD-L1高表达的GEAC患者中 , 纳武利尤单抗联合化疗相比于单独化疗而言 , 确实可改善患者的生存期[2] 。 那么 对于PD-L1低表达的GEAC患者 , ICIs的治疗效果究竟如何呢?
这个问题很快迎来了答案 。
近日 , 来自 新加坡国立大学癌症研究所的Raghav Sundar教授团队 , 在《临床肿瘤学杂志》发文 , 他们通过对3个GEAC临床队列进行回顾性分析 , 发现 在PD-L1低表达的患者中 , 行化疗+PD-L1抑制剂与单纯化疗相比 , 患者总生存期(OS)及无进展生存期(PFS)均无明显差异(P=0.678)[3] 。
这一结果表明 ,在PD-L1低表达的GEAC患者中 , 化疗基础上联用ICIs并未使患者有明显的临床获益 。
▲ 文章首页截图
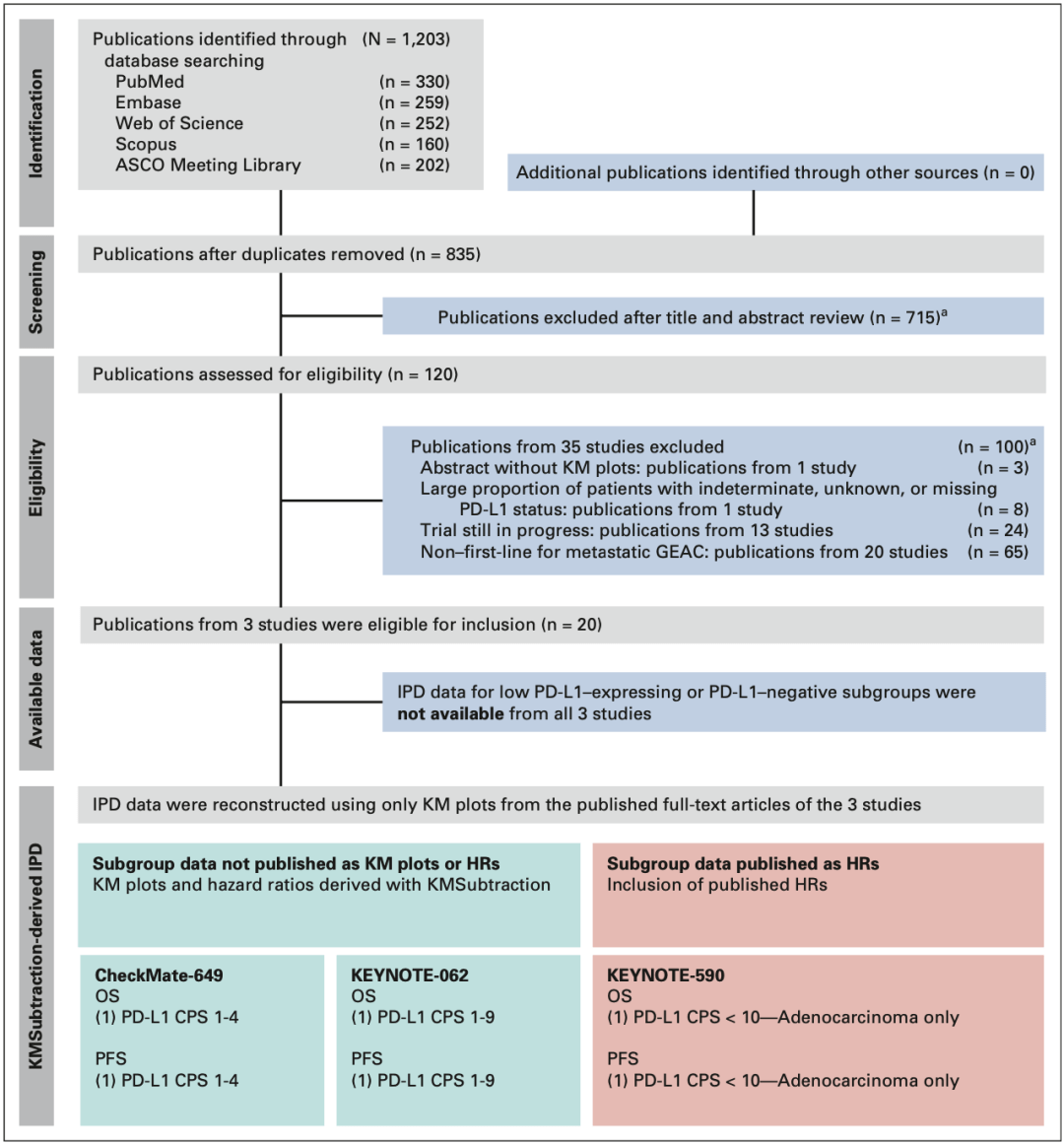
Sundar教授团队通过在EMBASE , Scopus , PubMed , Web of Science及ASCO 等数据库 , 对关于进展期GEAC患者行免疫治疗的III期临床研究进行检索 , 并对结果进行逐步筛选筛选 , 仅纳入同时包括患者KM曲线及PD-L1综合阳性评分(CPS)的临床研究队列 。
文章图片
▲ 图1:研究的PRISMA流程表
最终只有三个临床队列符合要求:CheckMate-649[2] , KEYNOTE-062[4] , 及KEYNOTE-590[5] 。 其中KEYNOTE-590队列中有一小部分患者(19/749人 , 2.54%)缺乏PD-L1 CPS评分 , 不过相对整体而言可以忽略不计 。
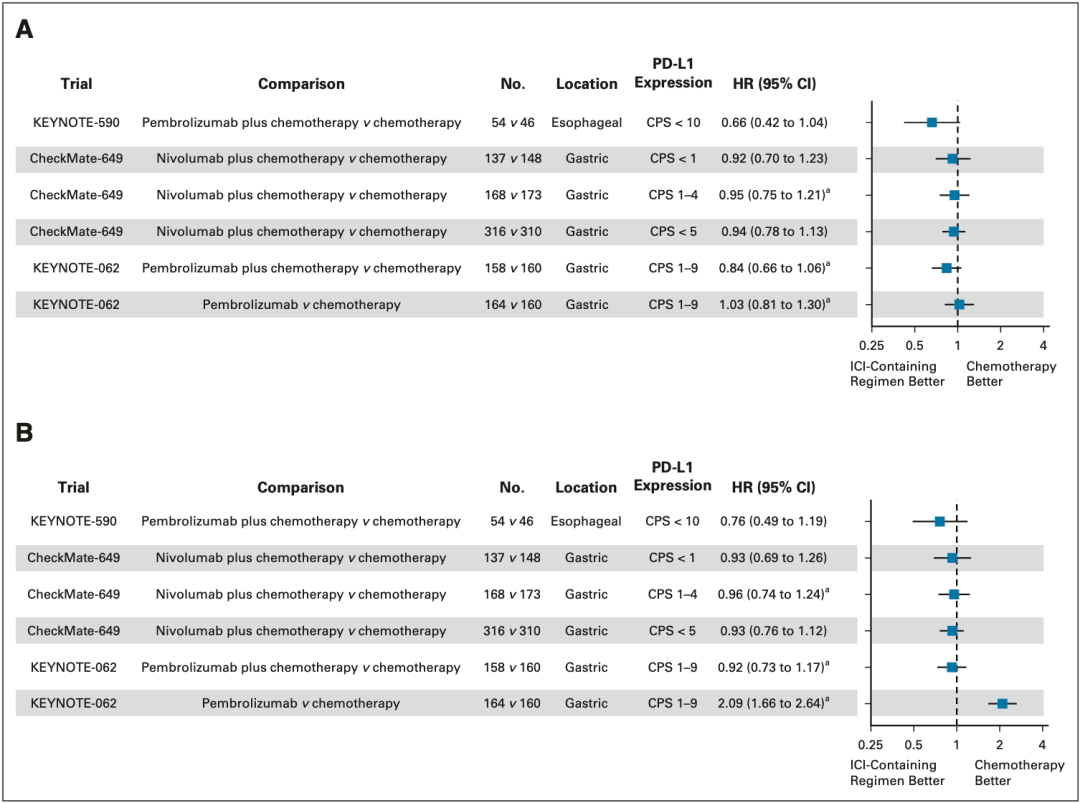
接下来 , 研究者们选择CheckMate-649队列中PD-L1 CPS<1 及 CPS<5的患者亚组 , 对其OS及PFS的KM曲线采用KMSubtraction算法[6]进行重新分析;此外 , 他们也对KEYNOTE-590队列中PD-L1 CPS<10的食管癌患者组、KEYNOTE-062队列中PD-L1 CPS 1-9分的胃癌患者组进行分析 , 结果发现 在各亚组患者中 , ICIs+化疗组相比于单独化疗组并未改善患者的OS及PFS(图2) 。
文章图片
▲ 图2:各临床队列亚组KMSubtraction重建后的OS(A)和PFS(B)森林图
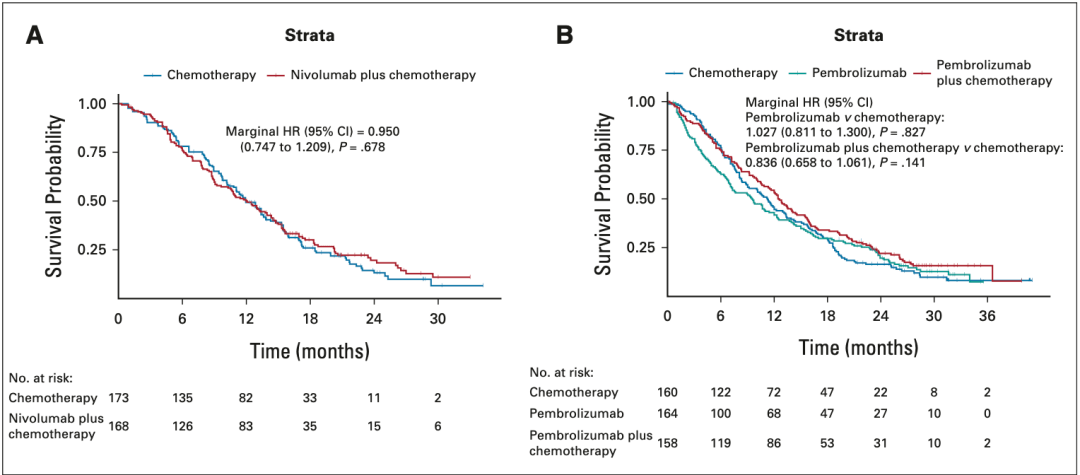
具体而言 , 在CheckMate-649队列的PD-L1 CPS 1-4分的亚组患者中 ,纳武利尤单抗联合化疗组与单纯化疗组患者的OS无明显差异(HR=0.950 , P=0.678;图3A);与之类似 , 在KEYNOTE-062队列CPS 1-9分的亚组患者中 ,与单纯化疗组相比 , 帕博利珠单抗组(HR=1.027 , P=0.827) 及帕博利珠单抗联合化疗组(HR=0.836 , P=0.141)对患者OS的改善也不显著(图3B) 。
文章图片
▲ 图3:CheckMate-649及KEYNOTE-062队列亚组KMSubtraction分析后的OS
同样地 , 在CheckMate-649(图4A)及KEYNOTE-062(图4B)队列的PD-L1低表达亚组中 ,免疫治疗的加入也未能延长患者化疗后的PFS 。 此外 , 他们还发现 帕博利珠单药组与化疗组相比 , 患者的PFS反而显著缩短(HR=2.092, P<0.01) 。
- 脏腑|重庆肿瘤专科医院:中医帮你调和气血,平衡阴阳
- 心血管疾病|这个病还是“夫妻病”,你知道吗?
- 预防肿瘤|夜里温度下降孩子睡不好,多吃营养菜,补虚暖胃,提高抵抗力
- 致癌|十多种肿瘤与“吃”密切相关,看完请注意避开!
- 肿瘤|健康大讲堂丨肿瘤专家袁芃:乳腺癌病因尚不明确 防治重在“三早”
- 香港|广州复大肿瘤医院案例966:香港胰腺癌患者赴广州就医重获新生
- 诺西那生|“庆幸自己生在这个未来可期的时代!”
- 胶质瘤是脑内最常见的恶性肿瘤之一|胶质瘤能治好吗?复发后有必要再次手术吗?医生说了实话
- 堂姐|手和脚跟干燥开裂,又疼又丑,用这个专研的修护膏,一抹水润滑嫩!
- 尿酸|吃什么能溶解尿酸结晶?辟谣:尿酸值控制到这个数才可以
