
文章图片
2023年5月以来 , 加拿大杨梅生物制药公司(Arbutus Biopharma)对新药研发管道进行了更新 , 包括已在法国巴黎举行2023年全球肝炎峰会上(GHS-2023)口头报告中强调了AB-729(一种在研HBV RNAi疗法)非治疗数据以及AB-161(一种在研RNA去稳定剂)第1期临床开发首例受试者完成给药 。
【桑葚|乙肝杨梅制药更新,AB-729取得积极进展,AB-161完成1期首例给药】乙肝杨梅制药更新 , AB-729取得积极进展 , AB-161完成1期首例给药
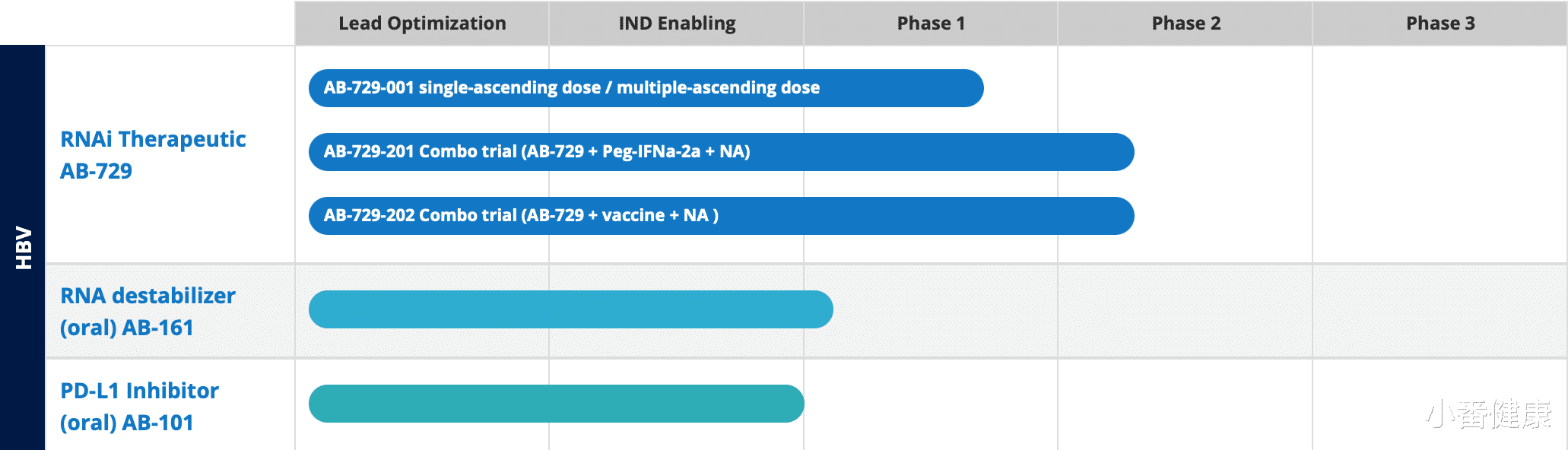
AB-729最新临床开发进展(多项2a期试验中)
在今年4月份的全球肝炎峰会上 , Arbutus公司口头报告了一项1b期临床试验(AB-729-001研究)中 , 已经停用AB-729和核苷(酸)类似物(NA)受试者的额外非治疗数据 。 这7名剩余的患者在停止所有治疗后继续保持较低HBVDNA水平 , 乙肝表面抗原(HBsAg)水平在最后一剂AB-729治疗后的1.5年内仍然低于基线(-0.8至-1.6 log10) 。
目前 , Arbutus公司正在继续评估AB-729与正在进行的NA疗法和短疗程PEG-IFNα-2a(IFN)组合疗法应用于43名慢性乙型肝炎病毒感染患者(cHBV)的安全性和耐受性 , 该研究是一项2a期临床试验(AB-729-201研究) 。 该试验前期阶段初步数据进一步验证了AB-729在调降HBsAg的能力 。 Arbutus公司预计 , 将在2023年第二季度公布AB-729+NA+IFN组合疗法的初步数据 。
同时还正在进行评估AB-729+NA疗法+Vaccitech公司研发的VTP-300(一种HBV抗原特异性免疫疗法)的2a期临床试验(AB-729-202研究) 。 Arbutus公司介绍 , 一旦该试验的初始部分完成招募 , 将开始在该试验的另一个部分招募20名受试者 。
这些受试者将接受AB-729(每8周60毫克)+NA治疗24周 , 然后接受VTP-300加1至2个低剂量的nivolumab(Opdivo?) 。 Arbutus公司预计 , 将在2023年下半年获得AB-729+NA+VTP-300的初步数据 , 预计在2023年第二季度为接受AB-729、NA、VTP-300和nivolumab的额外试验组的首位受试者开始用药 。
AB-161最新临床开发进展(刚进入1期)
今年3月 , Arbutus公司已经对AB-161第1期临床试验开始首例在健康受试者给药 , 预计将在今年下半年获得单次递增剂量数据 。 AB-161是Arbutus公司研发的下一代口服HBV特异性RNA去稳定剂 , 开发作为功能性治愈HBV的潜在全口服方案一部分 。
已于今年全球肝炎峰会上 , Arbutus公司展示了AB-161的临床前数据 , 显示AB-161具有强大抗HBV活性 , 包括在体外和体内抑制HBVRNA和HBsAg产生 。 与其他类别HBV抑制剂相比 , AB-161的抗HBV作用模式有所区别 , 这表明AB-161有可能是功能性治愈cHBV的一个重要组成部分 。
AB-101(新药临床试验申请被FDA搁置)
今年4月 , Arbutus公司已收到FDA口头通知 , AB-101的IND申请被搁置在临床上 。 Arbutus公司介绍 , 为明确起见 , 101的第1期临床试验尚未启动 , 也未向任何一位受试者使用AB-101 。 Arbutus公司不打算在今年下半年报告AB-101第1期临床试验的单剂量部分初始数据 。
AB-101是一种口服PD-L1抑制剂 , 以唤醒和提高cHBV患者免疫系统 。 迄今为止产生的临床前数据表明 , AB-101具有很强效力 , 能够介导cHBV患者的HBV特异性T细胞的激活和重振 。
来自Arbutus公司总裁兼首席执行官William Collier点评2023年第一季度乙肝新药研发进展:在2023年全球肝炎峰会上 , 我们报告了管道内乙肝在研新药RNAi疗法AB-729数据 , 显示大多数患者在最后一剂AB-729后至少1.5年 , 他们的乙肝表面抗原和HBVDNA继续维持低水平 。 此外 , 在1期临床试验中对首位健康受试者注射了AB-161 , 这是Arbutus公司研发的口服RNA去稳定剂 , 预计今年下半年会有数据 。
- 桑葚|4款药物从处方药转为非处方药,专家:药品安全性良好
- 肝硬化|乙肝/丁肝GHS-2023,REP2139-Mg联合TDF,HDVRNA和HBsAg下降
- 乙肝|柳叶刀:全球约1/6的新发癌症由炎症所致,是时候“消消炎”了
- 熬夜|乙肝在研新药AB-101,一种口服PD-L1抑制剂,FDA暂停其临床申请
- 乙肝|乙肝GHS-2023前瞻,在研新药PBGENE-HBV,将更新临床前新数据
- 乙肝|乙肝GHS2023,将带来AB-729及161数据,RBD1016将在欧肝会更新
- 乙肝|发病率已跃居第二!早期肠癌的治愈率几乎是100%,这项检查至关重要!
- 桑葚汁|桑葚汁的功效与作用及禁忌有哪些?
- 乙肝|乙肝2023欧肝会前夕,Aligos提交七份摘要,五份与新药研发有关
- 医生|乙肝Vaccitech制药更新,新型T细胞免疫VTP-300,002及003研究
