数据|新冠口服药即将问世?四季度关注这4家公司3期临床揭盲 | 见智研究所( 四 )
入组标准:出现症状后5天内有一种或多种轻度或中度症状与COVID-19相关的症状 。
主、次要终点:800mgMolnupiravir每12小时口服一次 , 共5天(共10剂) 。 根据第29天住院和/或死亡的参与者百分比评估 , Molnupiravir优于安慰剂 。 主要终点:受试者住院和/或死亡的参与者百分比(时间范围:最多29天);次要终点:受试者持续症状改善或消退时间 。
预计主要完成时间:2021年11月8日
②2021年7月12日 , 印度Hetero公司公布了Molnupiravir在印度的开放性III期临床试验数据 , 试验入组1218例患者 , 评估Molnupiravir(800mgBID)联合SOCvs.SOC在轻症患者中的有效性和安全性 。 Molnupiravir在症状改善、转阴率和住院率等多个指标上表现出良好的治疗效果 。 (该试验并未登记在ClinicalTrials网站)
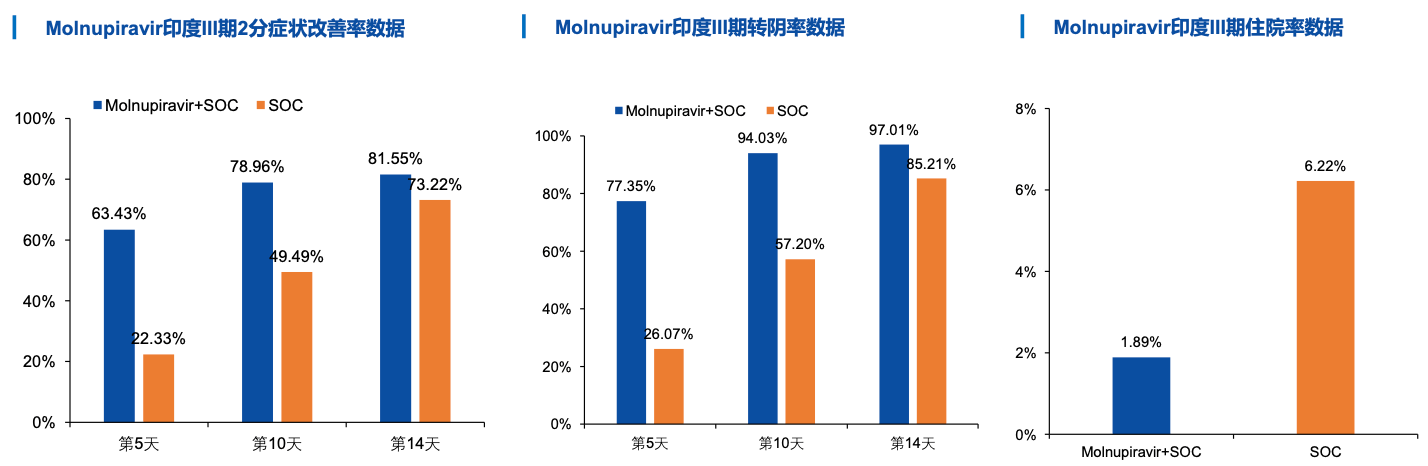
文章图片
③针对暴露后预防的3期临床(官网链接 , 还未在ClinicalTrials网站查到)
默克在9月1日宣布新开了Molnupiravir针对暴露后预防的3期临床试验 , 对象是新冠患者的密切接触对象(处于同一住所) 。 给药方式是800mg每12小时一次 , 连续5天 。 研究终点是14天内感染比例 。

文章图片
由于数据还未在ClinicalTrials查到 , 华尔街见闻·见智研究所后续将会持续更新该临床动态 。
3、AT-527——罗氏/Atea
AT-527(RO7496998)也是RNA聚合酶抑制剂 , AT-527进入人体后可转化为游离碱AT-511(抗新冠病毒EC90达到0.47μM) , 随后能够生成抗新冠病毒活性更高的三磷酸代谢产物AT-9010 , 体外抗新冠病毒活性较Molnupiravir高5-8倍 。 由于AT-527可以靶向包括RNA依赖性RNA聚合酶(RdRP)在内的两种对病毒RNA复制和转录至关重要的聚合酶 , 因此对新冠病毒具有独特的双重抑制机制 。
该药物由Atea公司研发 , 罗氏以3.5亿美元前期付款和后续里程碑付款获得了AT-527在美国以外治疗COVID-19的权益 。 公司认为 , 该款药物不但可以作为口服疗法治疗住院COVID-19患者 , 而且可能成为非住院患者的首个口服治疗选择 , 还具有作为暴露后预防性治疗的潜力 。
2021年6月30日 , Atea公司发布了AT-527临床II期双盲治疗住院患者的初步数据:62例患者 , 550mgBID , 给药5天 , 在接受治疗的第2天 , 与安慰剂相比 , AT-527组的病毒载量下降了0.7log(80%);在第14天 , AT-527组47%的患者转阴 , 安慰机组22%的患者转阴 。
华尔街见闻·见智研究所认为AT-527的2期数据目前看来不如Molnupiravir , 但公司表示未来有潜力用作暴露后预防性治疗可作为关注点 。 同时 , 公司在临床设计上与默克也采取了差异性方案 , 以症状开始缓解时间作为主要目标 , 预计年内将有3期数据公布 。
【数据|新冠口服药即将问世?四季度关注这4家公司3期临床揭盲 | 见智研究所】主要临床试验进展:
①美国注册 , 针对门诊新冠轻中症患者的临床3期试验(正在进行)
文章图片
研究方式:该研究是多中心试验 , 比较AT-527与安慰剂针对轻中型成年和青少年新冠患者疗效 。 约1386名受试者将随机分配到实验组和安慰剂组 。
入组标准:出现症状后5天内有一种或多种轻度或中度症状与COVID-19相关的症状 。
主、次要终点:口服550mgAT-527 , 每天两次(BID) , 持续5天 。 主要终点:缓解或改善COVID-19症状的时间(21.5小时)[时间范围:最多29天]新症状的缓解被定义为从随机化到分数保持为0或1至少21.5小时的时间长度;次要终点:缓解或改善COVID-19症状的时间(43小时)[时间范围:最多29天]新症状的缓解被定义为从随机化到分数保持0或1至少43小时的时间长度 。
- 治疗|糖尿病服药后,出现的低血糖比较严重怎么办?
- 全球疫情|如有新冠相关表现 早就诊 不自行服药
- 发热|北京市新增本土病例曾出现发热等症状 自行服药未就诊
- 数据|推动惠民利民数字健康应用,人民数据与健交科技达成战略合作
- 数据|《胃肠病学》:减肥防早发肠癌,要从20岁开始!科学家发现,20、30岁和约45岁时肥胖,与结直肠癌发病风险上升88-156%有关
- 气道|老年人吃饭服药应注意啥?请看这里!
- 北京新增一例新冠确诊病例,曾自行服药,活动轨迹曝光!
- 代谢产物|吸烟+服药=?这些不良影响是真的!
- 新冠|韩国正式供应新冠口服药
- 并发症|高血压一开始服药就不能停?只有两种情况需要,这种情况没必要
