相互作用|药物基于“肠-脑”通路的研究进展( 六 )
文章图片
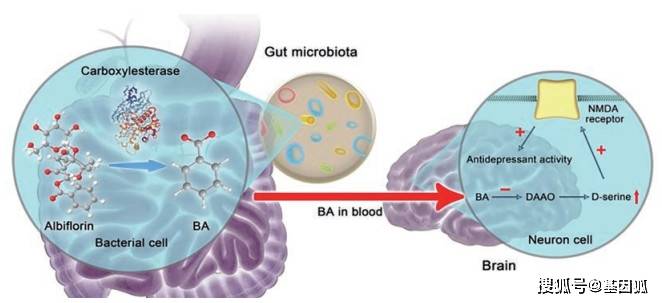
Figure 1 Gut-brain axis metabolic pathway regulates antidepr
小檗碱(berberine, BBR) 是一种从黄连和刺檗等中草药中分离出来的天然化合物, 在中国已被用于治疗腹泻患者的非处方药(OTC) 。 自2004年以来, 蒋建东课题组等已经确认BBR是一种安全有效的治疗高脂血症和2型糖尿病的药物, 其机制新颖[108] 。 在过去的十年中, BBR降低血脂和血糖的临床疗效得到了广泛的证实[108-111] 。 此外, 多个研究团队报道了BBR对脑功能是有益的[112-115] 。 由于BBR口服后在肠道中吸收不佳[116-118], 并在肠道中的浓度很高, 揭示了BBR与肠道菌群之间可能的相互作用, 以及BBR可能具有连接肠道菌群和中枢神经系统的化学机制 。
由于肠道菌中含有丰富的代谢酶[119], 这与脑中重要的神经递质左旋多巴可能存在密切的关系 。 中国医学科学院药物研究所的研究团队发现小檗碱是肠球菌中酪氨酸羟化酶的激动剂, 并可能导致肠道中左旋多巴的产生(尚待发表) 。 研究者对小鼠经口给予小檗碱后发现, 小檗碱可经肠道菌群中硝基还原酶产生二氢小檗碱, 这一过程提供了氢自由基并促进二氢生物蝶呤生成四氢生物蝶呤 。 由于四氢生物蝶呤可增强酪氨酸羟化酶的活性, 从而加速肠道菌群产生左旋多巴 。 而肠道菌群产生的左旋多巴通过循环系统进入大脑, 并转化为多巴胺, 改善了帕金森病中多巴胺缺乏的主要病理表现[120] 。 为了验证小檗碱激活“肠-脑”轴的作用, 研究者利用粪菌移植手段将粪肠球菌以及屎肠球菌分别定殖到了帕金森病小鼠的肠道中, 显著提高了小鼠大脑中的多巴胺水平, 改善了其帕金森病的症状, 并且小檗碱与粪菌移植联用具有更好的治疗效果 。 这一研究提供了天然药物通过“肠-脑”轴通路改善大脑神经精神疾病的直接证据 。
黄酮醇类物质也具有类似的作用机制, 并被体内外研究证实具有抗焦虑活性[121] 。 Cica等[122]比较了不同给药途径对山柰酚、槲皮素和杨梅素等黄酮醇类化合物的代谢影响 。 结果发现, 仅在口服后才检测到特定的代谢产物对羟基苯乙酸(p-HPAA) 和3, 4-二羟基苯基乙酸(DOPAC), 并对小鼠产生抗焦虑效应; 而腹腔注射后未观察到抗焦虑作用 。 有趣的是, 当上述代谢产物p-HPAA和DOPAC腹腔注射小鼠后展现了抗焦虑活性, 并且抗生素恩诺沙星可抑制肠道菌群的代谢转化, 从而使抗焦虑作用消失 。
多种天然药物提取物也能通过肠道菌群发挥治疗神经精神疾病的药效 。 已有报道从巴戟天提取的菊粉型低聚寡糖(inulin-type fructo-oligosaccharides, FOSs) 被证明具有抗抑郁作用, 并被国家食品药品监督管理局批准为处方中药治疗轻度至中度抑郁症 。 Chi等[123]观察到FOSs减轻了CUMS大鼠抑郁症样行为并恢复了肠道菌群的生态平衡, 包括蓝藻细菌等菌门丰度增加, 并且该类细菌可分泌H2S等抗抑郁代谢产物; 而肉苁蓉提取物则是通过肠道菌群影响了神经活性代谢物SCFAs的产生, 进而恢复抑郁大鼠脑内5-羟色胺和BDNF的表达, 改善了抑郁样行为症状[124] 。 文冠果壳苷也是通过调节AD大鼠肠道菌群改善了相关的AD症状 。 其中包括多个门属水平的丰度变化, 特别是厚壁菌门与拟杆菌门的比例改变; 同时肠道菌群的变化与氨基酸、溶血磷脂酰胆碱、二氢鞘氨醇、植物鞘氨醇、肌苷和次黄嘌呤等内源性代谢物显著相关[125] 。 此外, 迷迭香[126]、黄连[127]等天然药物提取物也能重塑肠道菌群结构改善神经精神疾病 。
6 总结与展望
长久以来, 肠道在维持体内稳态方面发挥着不可忽视的作用, 特别是在过去的十多年间, 肠道菌群的深入研究使人们认识到肠道、肠道菌群与大脑这三者之间的相互作用 。 在神经精神疾病的生物学和生理学基础的领域中, “肠-脑”轴越来越受到关注 。 尽管如此, 多数研究只是看到了菌群的变化, 而并未深入探索菌群变化究竟是病因还是结果; 此外, 隔绝菌群等影响因素来验证研究结果依然困难重重, 无论是通过抗生素构建的相对无菌动物模型还是真正的无菌动物, 均存在各自的局限性 。 因此, 针对肠道菌群与药物, 尤其是神经精神疾病治疗药物的研究还需要更多关键技术上的突破, 这些技术涉及了肠道菌介导的药物代谢-药效研究领域的多学科交叉的前沿技术, 包括宏基因组测序技术、多组学与生物信息学技术、粪菌移植技术、肠道菌内源性代谢产物鉴定与定量分析技术等的运用与普及 。 此外, 菌群研究的一大难题就是如何定义健康的肠道菌群 。 由于个体间肠道菌群结构的差异, 使得统一肠道菌群的研究方法具有挑战性 。 然而, 也正是因为肠道菌的个体差异, 将可能导致神经精神类药物依赖肠道菌的临床个性化治疗新策略[128] 。- 他汀|转告父母:在服用他汀类药物时,少吃这5物,别不放心上
- 洛神花泡茶水喝的功效 天然保健药物
- 诺华|创新心血管药物英克西兰落地博鳌乐城
- 乙醇|除了头孢类药物,吃这些药也千万别喝酒
- 抗体|国家药监局:保障新冠病毒治疗药物质量安全和生产供应
- 杨阳|创新心血管药物英克西兰落地博鳌乐城
- 双硫仑|服用这些药物千万别喝酒
- 协调员|深化药物临床发展 提升科研综合实力——我院重症医学科召开药物临床试验项目启动会
- 性疾病|【医学科普】胆固醇不高,为什么还要吃他汀类药物
- 阿奇霉素|阿奇霉素不能随便吃,建议:服用阿奇霉素时,尽量避开3种药物
