肿瘤|《科学》子刊:紫杉醇“捧杀”癌细胞!
紫杉醇是乳腺癌治疗的基石 。
但是在临床应用中 ,只有大概半数的乳腺癌患者在紫杉醇治疗后能够达到缩小肿瘤病灶的效果 。
由于目前 没有能够预测患者对紫杉醇敏感性的生物标志物 , 医生很难确定紫杉醇对乳腺癌患者是否有效 。
近日 , 由美国威斯康星大学麦迪逊分校Beth Weaver领导的研究团队在著名期刊《科学转化医学》上发表重要研究成果[1] 。
他们发现 ,染色体不稳定性(CIN)水平高的乳腺癌患者对紫杉醇更敏感 , 因为紫杉醇可以进一步诱导癌细胞染色体的不稳定性 , 从而导致癌细胞死亡 。
总的来说 , 这项研究提出染色体不稳定性很有可能成为预测紫杉醇疗效的生物标志物 , 这对于紫杉醇的临床应用无疑是一个重大突破 。

文章图片
1971年 , 美国化学家M.C.Wani和Monre E.Wall首次将紫杉醇从短叶紫杉的树皮和木材中提取出来 , 并确定了它的结构 。
尽管紫杉醇的使用历史悠久 , 但它的抗癌机制仍存在争议 。 人们普遍认为 ,紫杉醇是通过抑制微管蛋白 , 进而抑制有丝分裂来发挥抗癌作用的 。 然而 , 其他抑制有丝分裂的药物在肿瘤治疗过程中收效甚微;而且在小鼠肿瘤模型和乳腺癌患者中 , 肿瘤缓解和紫杉醇诱导的有丝分裂停滞无关[2] 。 这些结果表明 , 紫杉醇是通过其他机制发挥抗癌作用的 。
为了探究紫杉醇真正的作用机制 , Wearor团队首先开展了一项临床实验 , 按照两种标准的治疗剂量方案对乳腺癌患者进行治疗 (每隔一周接受4剂175mg/㎡紫杉醇;连续12周接受80mg/㎡紫杉醇) 。
Wearor团队检测了在两种方案下乳腺癌患者的血浆和瘤内紫杉醇浓度 , 发现 患者体内的紫杉醇均处于较低浓度 , 而且肿瘤细胞的有丝分裂并没有被阻滞 。 这一结果再次说明 , 临床上使用的紫杉醇剂量 , 并不足以达到体外细胞培养中抑制有丝分裂的致死浓度 , 之前普遍认为的机制并不是紫杉醇抗癌的真正原因 。
奇怪的是 , Wearor团队发现 患者肿瘤细胞中多极纺锤体的比例大大增加了 。
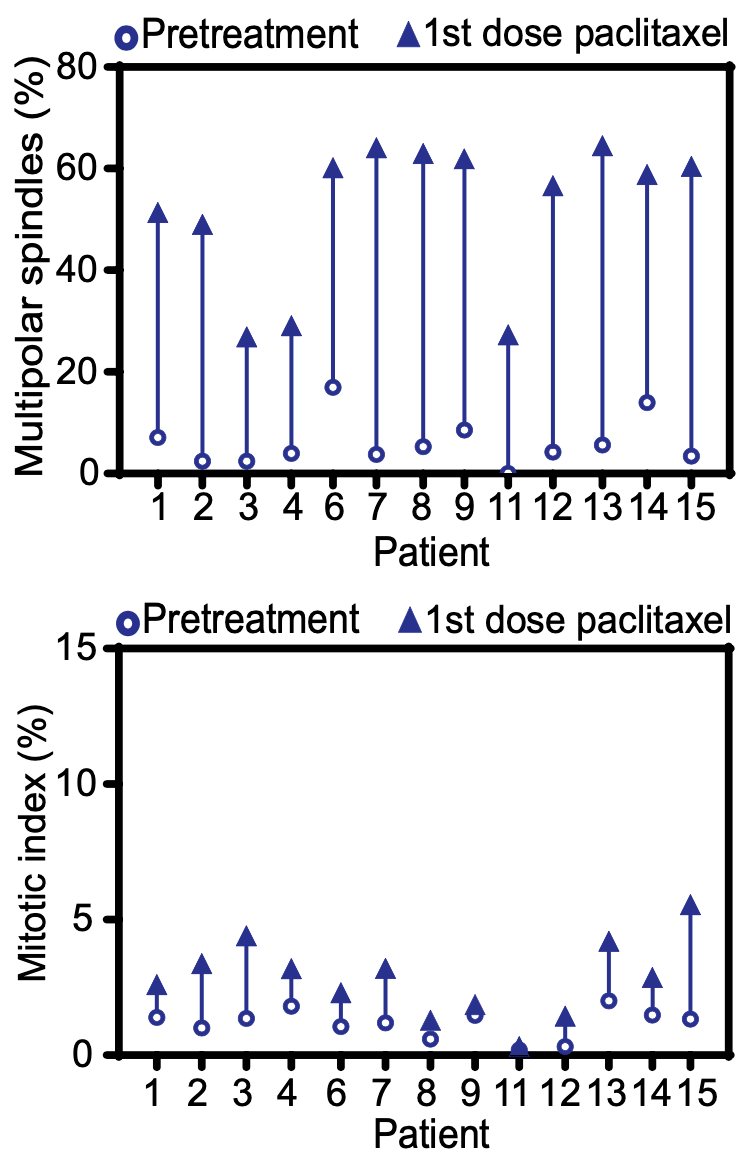
文章图片
紫杉醇对癌细胞有丝分裂的影响
我们都知道 , 细胞在正常有丝分裂时纺锤体有两个极 , 会将染色体均等地分离到两个子细胞中 。 当细胞存在多极纺锤体时 , 其染色体的后期分配会变得不规则 , 形成多个小核 , 进而产生多个子细胞 。
实际上 染色体不稳定性是癌细胞的一个普遍特征 , 并且可能是肿瘤形成的重要机制 , 因此绝大多数肿瘤会表现出染色体不稳定性 。不过, 如果染色体高度不稳定 , 就会导致肿瘤细胞死亡 。
那么紫杉醇的抗癌作用是不是与多极纺锤体的形成有关呢?
为了回答这个问题 , Wearor团队在体外寻找低浓度紫杉醇的作用机制 。他们首先发现 经低浓度的紫杉醇处理后 , 每株乳腺癌细胞的多极纺锤体都明显增多了 , 这与在患者体内发现的现象是一致的 。
借助于时差显微镜 , 研究人员发现: 相比双极分裂 , 多级分裂更容易导致子细胞死亡 。显然 ,低浓度下紫杉醇细胞毒性产生的原因是多极分裂的增多 , 而不是有丝分裂的阻滞 。
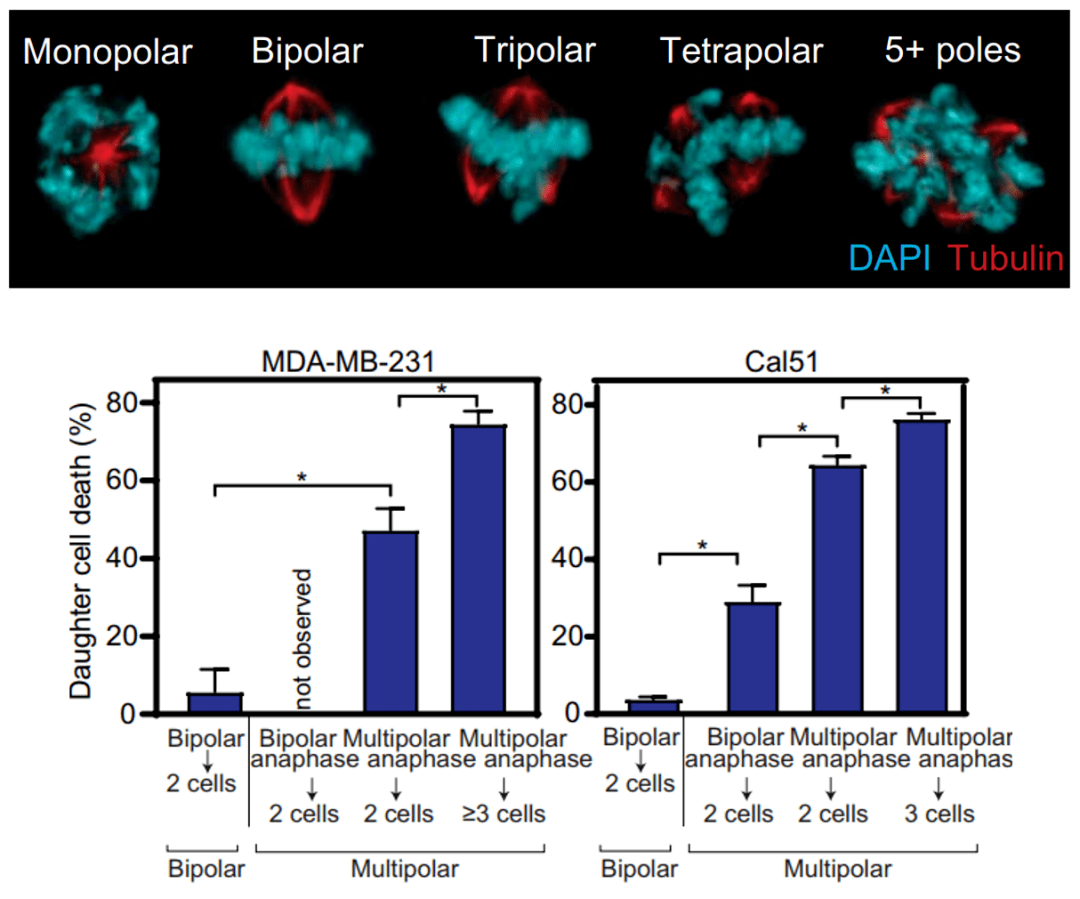
文章图片
(上)低浓度紫杉醇处理乳腺癌细胞后多极纺锤体明显增多;(下)乳腺癌细胞MDA-MB-231和Cal51中通过不同分裂方式生成的子细胞的死亡比例
那么接下来 , Wearor团队用了两种能够诱导多极纺锤体形成 , 但不会抑制细胞周期的办法 (抑制微管动力蛋白HSET和扩增中心体)验证前面的发现 。
- 卫生室|《乡村医生诊疗口袋书(先行本)》面世
- 鲁南制药集团|菏泽医学专科学校“鲁南制药产业学院”揭牌
- 收发|一图读懂 | 科学收取快递 做好健康防护
- 脏腑|重庆肿瘤专科医院:中医帮你调和气血,平衡阴阳
- 预防肿瘤|夜里温度下降孩子睡不好,多吃营养菜,补虚暖胃,提高抵抗力
- 致癌|十多种肿瘤与“吃”密切相关,看完请注意避开!
- 解读|《浙江省医院门诊管理办法》政策解读
- 肿瘤|健康大讲堂丨肿瘤专家袁芃:乳腺癌病因尚不明确 防治重在“三早”
- 方面|“四九”第一天,科学养生,健康过冬
- 廉东波|《健谈》观点丨浅表性胃炎三五年复查一次 萎缩性胃炎一年一查
