文章图片
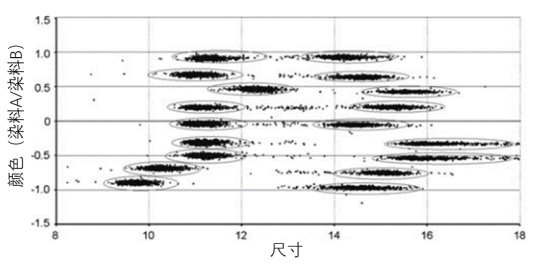
图二
图二, 18个微珠群体的编码 。 微珠群体由两种不同的荧光染料以不同比例组合编码 , 并作为灰度值处理 。微球位于微孔板孔的透明底部便于对焦 。 微珠不需要固定 。 在每个加样孔中 , 可同时测量多个微珠群(多参数) 。 微珠成像通常使用10 9/0.30物镜进行 , 该物镜能够对直径为6–30 微米的微珠进行成像 , 在相机传感器上创建直径为9个像素的图像(像素大小6.5 *6.5 微米) , 这对于图像处理来说是足够的分辨率 。 由于景深仅为2.7 微米 , 因此必须有自动算法进行自动对焦 。 理论上 , 每个图像覆盖670 *900 微米的区域 , 包含多达500个单个微珠 。 荧光激发的强度不是恒定的 , TR-sWSI-Fluo只使用不同荧光通道之间的比率 , 而不是绝对值 。 荧光染料的比例对于每个微珠群体都是特定的 。 此外还有直径大小也用作分类参数 。 每个微珠群的表面用特定抗原/抗体/核酸修饰 , 用来检测样品中的不同分析物 , 此时使用与构成微珠的两种荧光染料不同的第三种荧光染料染色 。 待检测物的结合导致微珠周围出现荧光光晕(图三) 。 强度由图像处理算法确定 。

文章图片
图三-A
图三-A. 单个微珠和其荧光标记的分析物(红色光晕) 。 分析物的强度在微珠的边缘进行测量或量化 。 微珠的身份鉴定通过其大小尺寸(直径)和荧光颜色ID得到:
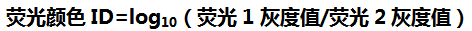
文章图片
文章图片
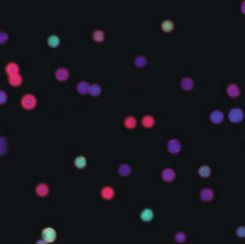
图三-B
图三-B. 七种微珠log10群体混合后的图像 , 密度约为700 /mm2微球数 , 红色外圆=阳性 。 直径和荧光颜色ID确保每个微珠分配给一个特定群体 , 且具有唯一性 , 使用这种方法的错误分类概率远低于1% 。 如果两种染料按1:10到10:1的比例对每个微珠进行编码 , 则可以计算-1到+1的荧光颜色ID 。TR-sWSI-FLUO应用于多重抗体(或抗原)检测:
文章图片
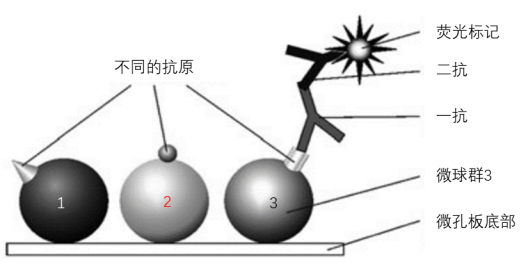
图四
图四. 抗体(或抗原)微珠检测方案 。 将携带不同抗原的三个微珠群1、2、3固定在微孔板上 。 抗体(例如特异性自身 , 图中标记一抗)仅与相应的抗原(微珠3表面的抗原)结合 。 一抗由荧光团标记的二抗体识别 , 在微珠3表面产生不同于微球本身颜色(二种荧光的混合)的第三种荧光 。TR-sWSI-FLUO应用于多重PCR:
文章图片
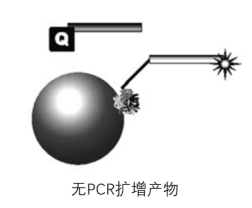
图五-A
图五-A. 基于微珠杂交探针的多重PCR 。 3‘’端荧光标记的单链捕获(通过核酸杂交)探针通过其5‘端’生物素与微珠表面的链霉亲和素结合 。 “显色探针”在其5°端标记有有淬火剂Q(Quencher) 。 在没有PCR产物杂交的情况下 , 保留捕获探针和检测探针在溶液中 , 不会发生荧光能量共振转移(FRET)荧光 。
文章图片
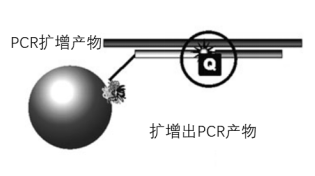
图五-B
图五-B. 基于微珠杂交探针的多重PCR 。 3‘’端荧光标记的单链捕获(通过核酸杂交)探针通过其5‘端’生物素与微珠表面的链霉亲和素结合 。 “显色探针”在其5°端标记有有淬火剂Q(Quencher) 。 当PCR扩增产物随着PCR反应进程其数量增加时 , “显色探针”和捕获探针与PCR扩增产物杂交 , 捕获探针3‘端’的荧光标记和显色探针5‘端的Q被安置在一起’而产生的FRET荧光(不同于微球和单链捕获探针3‘端’的荧光)
- 一项研究表示:连续半年|重磅突破!美科学家用“基于病毒的基因疗法”使寿命延长40%
- 导管|基于真实世界数据研究的MDT模式联合PDCA降低住院患者血管内导管相关血流感染发生率
- 工信部专家:基于手机上的物联网应用将是一大重要趋势
- 美国公司研制出基于噬菌体的“纯天然”除大肠杆菌产品
- 摘要: 屈光性白内障手术基于精准的测量、计算和分析|【医学前沿】从“看得见”转变为“看得清”,屈光性白内障手术迎来新时代
- 虽然我们常说健身要努力|基于合理训练与饮食,在自然健身的状态下,最多能长多少纯肌肉?
- 种类|基于抗体策略研发的试剂条 可在10分钟内诊断蛇伤类型
- 指导|《柳叶刀》:厉害了,中国科学家、中国技术!由中国专家牵头、基于中国技术、在中国完成的心血管领域随机对照临床试验首次登顶
- 技术|沈贤教授:基于影像组学的术前精准营养评估
- 相互作用|药物基于“肠-脑”通路的研究进展
