(GM:完全培养基;SM:模拟FMD培养基)
总之 , 索拉非尼与FMD在治疗HCC上具有协同作用 , 两者联合治疗能破解HCC细胞对索拉非尼的耐药性问题 , 提高疗效 。
从机制上看 ,索拉非尼是线粒体呼吸的非典型抑制剂 , 会导致癌细胞氧化磷酸化 (OXPHOS) 过程受损 , 使癌细胞转为无氧呼吸 , 通过增强糖酵解来提供能量[9,10](也就是发生Warburg效应[11]) 。
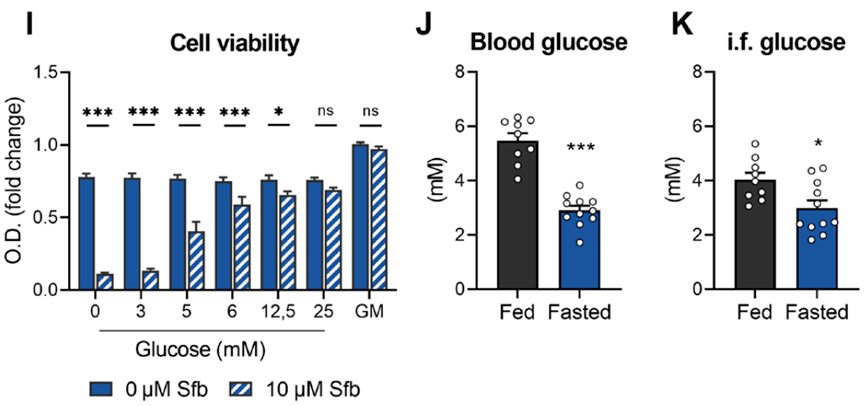
糖酵解需要消耗大量葡萄糖 。 Prokesch和他的同事们在HepG2细胞的体外实验中发现 ,索拉非尼治疗后的癌细胞活力会随葡萄糖剂量的增加而逐渐恢复 。 当培养基中葡萄糖浓度为3mM时 , 细胞活力还没啥起色;当葡萄糖添加到5mM时 , 就有约50%的癌细胞恢复活力 。
而在小鼠体内的异种移植实验中 , 他们发现 , FMD喂养的小鼠血糖水平显著降低至约3mM 。 这说明 ,凭着FMD就足以将体内血糖降至一定水平 , 降低HCC细胞在使用索拉非尼后的存活率 。
文章图片
I:体外实验中 , 葡萄糖水平为3mM时 , 可以维持很低的细胞活力
J、K:体外实验中 , FMD足以将血糖水平降至3mM
简单来说就是 ,索拉非尼堵住HCC细胞有氧呼吸的路 , 转型为糖酵解;而FMD又会导致HCC细胞的糖酵解也没糖可用 , 从而联手索拉非尼将HCC细胞逼向绝路 。
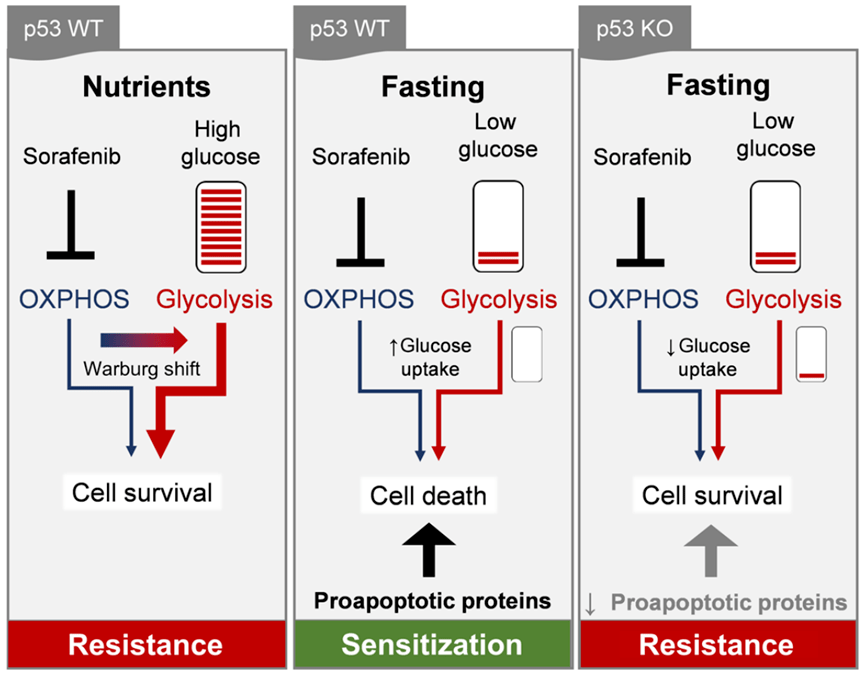
研究者们进一步研究发现 , FMD不仅能够降低血糖 ,还能阻断AKT/mTOR信号通路 , 增加HCC细胞对索拉非尼的敏感性 。
值得注意的是 ,p53能够通过调节葡萄糖转运蛋白和促凋亡蛋白的表达 , 在FMD+索拉非尼的协同治疗中起关键作用 。
当敲除HepG2 细胞中的p53基因时 , FMD与索拉非尼对HepG2 细胞的“合体攻击”就失效 , 不会出现显著的细胞活力降低或是细胞毒性加强 。 一旦p53重新表达 , FMD就又能增加HepG2 细胞对索拉非尼的敏感性了 。
文章图片
依赖于p53信号的FMD与索拉非尼在HCC治疗中的协同作用
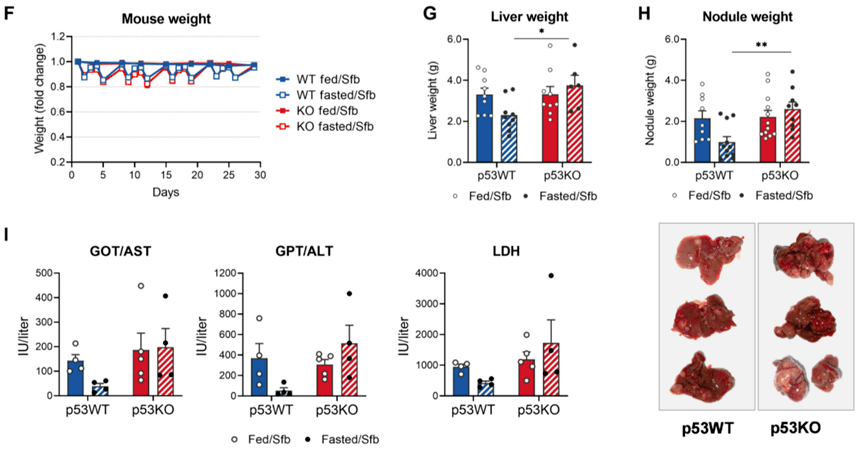
前面的研究中 , Prokesch和他的同事们用的都是对索拉非尼具有耐药性的HCC细胞 。 最后 , 他们还在非耐药性HCC细胞移植的小鼠模型以及原位HCC小鼠模型中 , 再次证明了FMD+索拉非尼的协同疗效 。
文章图片
原位HCC小鼠中 , FMD+索拉非尼的疗效
(p53WT:p53正常表达;p53KO:p53敲除)
总体而言 , Prokesch和他的同事们发现 , 模拟禁食饮食能够增强索拉非尼在肝细胞癌治疗中的疗效 , 提高肝细胞癌细胞对索拉非尼的敏感性 。 这种协同作用依赖于癌细胞中p53信号的正常表达 。
研究者们表示 ,索拉非尼+模拟禁食饮食的联合治疗 , 相当于对癌细胞代谢造成“双重打击” 。 索拉非尼堵住癌细胞有氧呼吸的路 , 模拟禁食饮食夺走癌细胞糖酵解的底物 , 让癌细胞为获取能量时无路可走 。
这项研究结果不仅为晚期肝细胞癌患者提供了一种新的治疗策略 ,证明模拟禁食饮食疗法在肝细胞癌中具有临床应用的可能性 。 同时也提示着 , 在未来临床上使用模拟禁食饮食+索拉非尼的联合治疗时 ,患者的p53表达情况是个不可忽视的指标 。
参考文献:
[1] Wei, M. et al. Fasting-mimicking diet and markers/risk factors for aging, diabetes, cancer, and cardiovascular disease. Sci. Transl. Med. 9, eaai8700 (2017).
[2] Brandhorst, S. et al. A periodic diet that mimics fasting promotes multi-system regeneration, enhanced cognitive performance, and healthspan. Cell Metab. 22, 86–99 (2015).
- 血液|《科学》:炎症竟会循“味儿”而动!科学家发现,血管巨噬细胞存在嗅觉受体,与血液中的辛醛互作引发炎症,导致动脉粥样硬化丨科学大发现
- 《生活百科》生抽与老抽区别
- 于明|“网红吃法”不科学,别乱吃!生肉、生水要警惕
- 蛋白质|促睾好处多!4个方法科学促睾,让你力量充沛、健康有活力
- 技术|国家药品监督局发布《生物类似药临床药理学研究技术指导原则》
- 营养|《乡村爱情14》孕期的青莲刚吃完饭又饿,咋回事?
- 本文转自:新民晚报图说:本研究部分科研人员合影(前排右四为尹万超、右三为徐华强)来源/中...|上海科学家最新发现:奥密克戎感染力是野生型的近
- 吃法|“网红吃法”不科学,别乱吃!
- 本文转自:全民健康生活方式行动有没有适合老年人的运动?常做的运动是健步走|老年人如此运动才科学!最适合老年人的5种锻炼方式,马上做起来!
- 丛书|《中医治未病指导丛书》入选全国优秀科普作品
